
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции элиминирования
Образование алкенов является следствием реакций отщепления, или элиминирования.
Подобное направление процесса обусловлено природой реагента. Напомним, что в теории Бренстеда основанием называется частица, которая присоединяет протон. Как Вы знаете, необходимым условием для этого является наличие у такой частицы орбитали, содержащей пару электронов. Это может быть как неподелённая пара электронов (n -основания, например, спирты, амины), так и пара электронов π-связи (π-основания, например, алкены, арены).
С другой стороны, частица с парой электронов называется нуклеофилом. Термин «основание» характеризует исключительно взаимодействие с протоном, тогда как термин «нуклеофил» имеет более широкое значение и относится к реакции с любым электрофилом, включая H+.
Реакции элиминирования, как и любой процесс в химии, подчиняются определённым механизмам. Один из них Вам уже известен – это образование алкена в качестве побочного продукта при нуклеофильном замещении по механизму SN1.
Первая стадия процесса в точности соответствует таковой механизма SN1 – это лимитирующая стадия, приводящая к отщеплению уходящей группы (в данном случае – молекулы воды) с образованием карбокатиона. Второй стадией в этом случае является реакция с основанием (в данном случае анионом HSO4-или молекулой спирта). Происходит отщепление протона из соседнего положения к карбокатионному центру и получается алкен. При этом, в основном, образуется наиболее замещённый алкен (правило Зайцева) с транс-конфигурацией как более устойчивый.
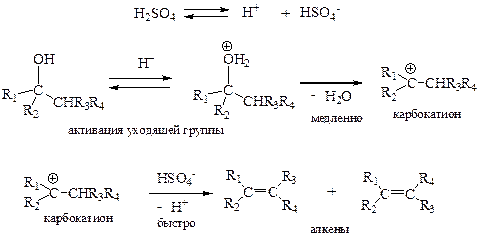
Подобный процесс получил название E1 – двухстадийный мономолекулярный механизм элиминирования. При этом скорость процесса зависит только от концентрации субстрата (и не зависит от концентрации основания!). Как и в случае механизма SN1, промежуточно образующийся карбокатион может подвергаться перегруппировке по тем же соображениям, что и высказанные ранее.
Для реализации механизма E1 благоприятны следующие факторы: пространственно затруднённый субстрат (третичный спирт, алкилгалогенид), слабое основание (вода, спирт, галогенид-ион).
Другой механизм элиминирования, как Вы, пожалуй, уже догадались, напоминает механизм SN2.
При этом молекула спирта или алкилгалогенида, подвергающегося превращению, «замирает» в конформации, в которой частично разорвана связь атома углерода с уходящей группой, а протон из соседнего положения частично связан с основанием (в данном примере – спирт). При этом протон, уходящая группа и два атома углерода находятся в одной плоскости, причём протон и уходящая группа расположены по разные стороны от образующейся двойной связи. Перемещение электронов связей происходит синхронно, т.е. одновременно.
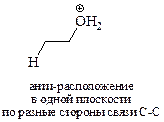
| 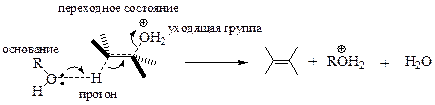
|
Данный процесс получил название одностадийный бимолекулярный механизм элиминирования и обозначается символом E2. При этом скорость процесса пропорциональна как концентрации субстрата, так и концентрации основания.
Для реализации механизма E2 благоприятны следующие факторы: первичный или вторичный субстрат, сильное основание (гидроксид-ион, алкоголят и т.п.), высокая температура, низкая полярность растворителя.
Как во всем этом разобраться?
После всего прочитанного в голове возникает каша. Есть уникальный рецепт: есть ряд типичных случаев, которые от Вас и будут требовать преподаватели – уровень школьной программы. Единственный верный путь – разобраться с ними (примерами, а не преподавателями!). Всё остальное Вы можете оставить «за кадром», если хотите уберечь Ваши головы и извилины от напряжения – это Ваш выбор. С другой стороны, учить органическую химию как таблицу умножения – труд бессмысленный и бесполезный. Наверное, именно изучение органической химии древними греками способствовало созданию легенды о Лернейской гидре – одну голову отрубишь, две вырастет (шутка, конечно, но в каждой шутке есть доля правды). Органическую химию нужно научиться понимать, ведь причины, лежащие в основе тех или иных превращений одинаковы!
Итак, вот перечень процессов, которые Вам необходимо знать
| Процесс | Субстрат | Реагент, условия | Примечания | |
| спирт →алкен | Перв. или втор. | H+ (кислая среда), нагрев. T > 140°C (выше для первичных) | E2 | Кислота должна быть достаточно сильной, а её анион – слабым нуклеофилом (иначе будет происходить замещение). Обычно применяют H2SO4, H3PO4, пара -толуолсульфоновую кислоту |
| Втор. или трет. | H+, нагрев., T > 140°C (выше для вторичных) | E1 | ||
| RHal → алкен | Перв. или втор. | OH- (щелочь) в спиртовом растворе или более сильное основание[12] | E2 | Если использовать сильное пространственно-затруднённое основание (LDA, t BuOK), то основным процессом является элиминирование по Гофману с образованием менее замещённого алкена (основание отрывает более «кислый» и более доступный протон) |
| Втор. или трет. | Основание: щелочь, третичный амин и пр. | E1 | ||
| RHal → ROH | Перв. или втор. | OH- (щелочь) в водном растворе | SN2 | Активность убывает в ряду иодиды > бромиды > хлориды >> фториды |
| Трет. | H2O, нагрев.[13] | SN1 | ||
| ROH → RHal | Перв. или втор. | Конц. галогеноводородная кислота, кроме HF | SN2 | Редко. Обычно используют реакцию с галогенидами фосфора или оксогалогенидами серы |
| Втор. или трет. | Сухой галогеноводород (газ) | SN1 |
|
|
Дата добавления: 2014-11-07; Просмотров: 1329; Нарушение авторских прав?; Мы поможем в написании вашей работы!