
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы получения фенолов
|
|
|
|
Реакции получения фенолов сводятся к нескольким способам. В качестве промышленного способа получения используют нуклеофильное замещение галогена в ароматическом кольце при нагревании хлорбензола с твёрдым гидроксидом щелочного металла при ~300 °C или каталитическое окисление изо -пропилбензола кислородом воздуха с последующим расщеплением образующейся гидроперекиси серной кислотой. При этом получаются фенол и ацетон – два важных промышленных продукта.

Ещё один способ получения фенолов основан на свойствах сульфоновых кислот. Сперва арен сульфируют действием концентрированной серной кислоты или олеума. Полученную сульфокислоту превращают в соль реакцией с гидроксидом натрия или содой, после чего сплавляют со щёлочью. В реакции получается соль фенола, которую превращают в фенол обработкой водным раствором кислоты. Таким способом получают, например, гидроксипроизводные нафталина. Этот метод важен также для получения мета -дигидроксибензола (резорцина).

Качественные реакции
Как таковых качественных реакций на одноатомные спирты нет. Однако есть совокупность свойств, которая обычно позволяет отличить спирт среди остальных веществ.
Спирты и фенолы реагируют с активными металлами с выделением водорода. При этом первичные спирты более активны по сравнению со вторичными, а вторичные – по сравнению с третичными. Плохо то, что активные металлы реагируют также и с водой(!), органическими и неорганическими кислотами, терминальными ацетиленами и даже жидким аммиаком.
Предельные спирты не реагируют с бромной водой.
Первичные и вторичные спирты обесцвечивают кислый раствор перманганата калия. Третичные спирты в обычных условиях не окисляются!
|
|
|
Многоатомные спирты в щелочной среде вступают в реакцию с гидроксидом меди (II) (голубой осадок) с образованием синего раствора (образуется хелатный комплекс).
Фенол не только обесцвечивают бромную воду, но при этом дает белый осадок 2,4,6‑трибромфенола.
Фенол даёт цветную реакцию с хлоридом железа (III) – фиолетовое окрашивание.
Пример 5. (качественные реакции)
Как химически различить следующие вещества: гексан, этанол, 2-метилбутанол-2, фенол, гексен-1? Опишите последовательность Ваших действий, напишите уравнения реакций, укажите признаки их протекания.
Решение.
Необходимо хорошо представлять себе химические свойства тех соединений, которые приведены в условии задачи. Для этого, во-первых, надо определить, к какому классу веществ они принадлежат, во-вторых, необходимо изобразить их структурные формулы.
| CH3(CH2)4CH3 | CH3CH2OH | 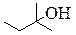
| 
| CH2=CH(CH2)3CH3 |
| Гексан (алканы) | Этанол (одноатомные спирты, первичный) | 2-метилбутанол-2 (одноатомные спирты, третичный) | Фенол (фенолы) | Гексен-1 (алкены) |
Существуют две пограничные стратегии решения.
Во-первых, можно воспользоваться «точечными ударами» и выбирать те реакции, которые характерны только для этого класса соединений. Тогда в одной пробирке (там, где целевое соединение) реакция идёт, в остальных – нет. Этот способ удобен тем, что почти не надо задумываться, как отреагируют остальные соединения на Ваш реагент. А вот можете ли Вы подобрать нужное число этих «точечных реагентов»? Очень часто может оказаться, что уникального реагента на Ваш класс соединений просто нет! Например, в общем случае нет реакций, позволяющих отличить алкен и алкин с внутренним расположением тройной связи.
Второй способ – использование «групповых реагентов». С их помощью Вы сразу же делите соединения на две группы: «есть реакция» или «нет реакции». Таким способом Вы разбиваете сложную задачу на более простые, каждую из которых решаете отдельно. Этот способ более труден в выполнении, требует большего напряжения и большего количества уравнений реакций. Но чем больше веществ Вам предстоит определить, тем более он эффективен. На практике поможет сберечь уйму времени.
|
|
|
При решении задачи на контрольной, лабораторной или экзамене Вас никто не будет ограничивать в выборе способа. Это Ваш выбор. Разумеется, никто не запрещает сочетать оба способа.
Как мы поступим при решении нашей конкретной задачи?
При решении таких задач используют метод проб и ошибок. На самом деле. В начале ответа пишем: «Возьмем чистые пробирки, пронумеруем их и отберем пробы каждого из определяемых реактивов. К каждой пробирке прибавим … В пробирке с … будем наблюдать … Пишем уравнение реакции. В остальных пробирках … (например, ничего не происходит). Значит, таким образом мы определили … [14]Вновь отберем пробы в чистые пробирки. К каждой пробирке добавим …» И т.д. Понятно? Теперь о тактике решения задачи.
Способ 1.
1. Определим фенол реакцией с раствором хлорида трёхвалентного железа. Признаком реакции будет фиолетовое окрашивание, остальные пробы не дадут никакого эффекта. Остались: гексан, этанол, 2-метилбутанол-2, гексен-1
2. Можем определить алкен (гексен-1) реакцией с бромной водой. Алкены обесцвечивают бромную воду, алканы и спирты с бромной водой не реагируют. Остались: гексан, этанол, 2‑метилбутанол-2
3. Самой большой проблемой является различение этанола и 2-метилбутанола-2, так как оба соединения принадлежат к классу спиртов. Однако этиловый спирт – первичный, а 2‑метилбутанол-2 – третичный спирт, поэтому он не окисляется кислым раствором перманганата калия. Алканы раствором перманганата калия также не окисляются. Добавление этилового спирта приведёт к обесцвечиванию раствора KMnO4. Остались: 2‑метилбутанол‑2 и гексан.
4. Третичный спирт можно отличить от алкана на основании его кислотных свойств. Так, добавив горошину натрия или калия, мы будем наблюдать медленное её растворение в спирте. С алканом реакция не идёт. Остался гексан. Запишем уравнения реакций с указанием признаков:
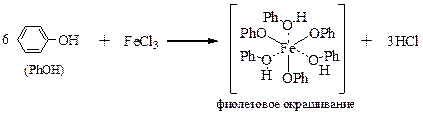
| В оставшихся пробирках реакция не идёт |
 Обесцвечивание Обесцвечивание
| В оставшихся пробирках реакция не идёт |
| 5CH3CH2OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O Обесцвечивание | В оставшихся пробирках реакция не идёт |

| С алканом реакция не идёт |
А Вы заметили, что на каждом шаге требуется проверка, что остальные вещества не вступают в реакцию? Именно здесь чаще всего совершают ошибки.
|
|
|
Способ 2.
1. Можно одним реагентом определить и фенол, и гексен-1. Реакция гексена-1 с бромной водой приводит к обесцвечиванию раствора, тогда как фенол не только обесцвечивает бромную воду, но и превращается в белый осадок 2,4,6-трибромфенола. Алкан и спирты в реакцию с бромной водой не вступают.
2. Спирты от алкана отличим благодаря их кислотным свойствам в реакции с натрием. В пробирке, где реакции нет – алкан. По скорости реакции можно определить, какой из спиртов первичный, а какой третичный.
3. Спирты между собой различим реакцией с перманганатом калия.

| Обесцвечивание раствора | В оставшихся пробирках реакция не идёт |
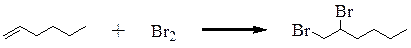 Обесцвечивание Обесцвечивание
| ||

| С гексаном реакция не идёт (метод исключения) | |
| 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2 | ||
| 5CH3CH2OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O Обесцвечивание | Третичный спирт в реакцию не вступает |
Проверять остальные вещества реагирует / не реагирует Вы должны обязательно, вдруг Вы обнаружите, что предлагаемый реагент проявляет тот же эффект в реакции с ещё одним соединением?
Наиболее часто встречаются такие ошибки
| Ошибка | Рекомендации |
| 1. Написана невозможная реакция | «Свои» реакции придумывать не стоит, почитайте учебник или лекции; |
| 2. Не указано, что происходит при добавлении реагента к другим веществам, признаки реакций. | Внимательность! Даже если реакция не идёт, обязательно это отметьте. Полезно использовать таблицу (см. ниже) |
| 3. Несколько веществ определены одновременно с помощью одного реагента. При этом не ясно, как автор отличает одно вещество от другого | Указывайте признаки реакции, даже если в задании об этом напрямую не сказано. Если признаки одинаковые, отличить вещества не удастся! |
| 4. Например, написаны 4 уравнения реакции, определены 4 вещества, а пятое? | Напишите: «название вещества» определили методом исключения (определили остальные, значит, в последней пробирке – оно!) |
| 5. Вещество не определили | Если не знаете, как определить, подумайте, какие свойства есть у данного вещества, которых бы не было у другого (других). Полезно составить таблицу – тогда Вы точно не забудете никого определить! |
|
|
|
Рекомендуемая таблица.
В столбцах Вы указываете Ваши вещества, которые определяете, в первом столбце – реагенты и условия (например, KMnO4, H+, t°C), в соответствующих ячейках – наблюдения. Для удобства в нашей таблице отсутствие реакции обозначено знаком «0», если реакцию не проводили – знак «‑». Уже на первом шаге удалось отличить вещество 1 и вещество 3. На втором шаге выявили различия между веществами 2 и 4.
В7-2. А теперь вопрос! Как Вы думаете, какие вещества могли бы быть зашифрованы? Предложите вещества, реагенты и запишите уравнения реакций! Это – для Вашей тренировки как грамотных и одарённых. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
| N | Действие | Вещество 1 | Вещество 2 | Вещество 3 | Вещество 4 |
| Реагент 1, условия | 0 (нет реакции) | обесцвечивание | обесцвечивание, белый осадок↓ | обесцвечивание | |
| Реагент 2, условия | - | - | красный осадок↓ | ||
| Реагент 3, условия | газ↑ без запаха, легче воздуха | газ↑ без запаха, легче воздуха | газ↑ без запаха, легче воздуха | ||
| Реагент 4, условия | газ↑ без запаха, тяжелее воздуха | ||||
| Реагент 5, условия | обесцвечивание | обесцвечивание | обесцвечивание | обесцвечивание |
Здесь в Вашей работе должны быть написаны уравнения всех реакций. Удачи Вам!
Пример 6. (синтез)
Предложите способ синтеза 3-метилпентанола-3 из неорганических реагентов
Решение.
Сначала изобразите то вещество, которое собираетесь получать: Вы вообще правильно представляете, о чём Вас спрашивают?
Затем наиболее продуктивно решать задачу в обратном порядке. Какие существуют способы получения спиртов? Изобразите целевую структуру и возможные «последние стадии». Желательно при этом на нашу схему пока не смотреть – она не всегда будет с Вами!
Логика такая: спирты получают гидратацией алкенов в кислой среде, значит, нужно выбрать алкен, который при присоединении воды превратился бы в 3-метилпентанол-3. Для этого нужно «отрезать» у спирта гидроксильную группу и атом водорода из соседнего к ней положения. Возможно 2 способа. Следовательно, синтетическими предшественниками могли бы выступать либо 2-этилбутен-1, либо 3-метилпентен-2. Присоединение воды происходит по правилу Марковникова через более устойчивый третичный карбокатион с преимущественным образованием более замещённого спирта – 3‑метилпентанола-3. Возможный метод получения, даже целых два!
Потратив немного времени, Вы получите схему, анализ которой поможет Вам найти более простой путь синтеза.

Последнюю стадию Вы осуществите без проблем в каждом из рассматриваемых случаев. Однако в методах (А) и (Б) Вы столкнётесь с трудностями при конструировании углеродного скелета молекулы-субстрата (алкена или алкилгалогенида) – уж очень он «разлапистый». Поэтому следует предпочесть методы (Г) или (Д). Они сразу же значительно упрощают структуру, так как разбивают одну сложную структуру на несколько более простых, каждую из которых можно синтезировать независимо.
В7-3. Вопрос на проверку: какой метод предпочтительнее (Г1) или (Г2)? Почему? Подумайте.
Метод (Д) может использоваться в тех случаях, когда 2 заместителя в структуре третичного спирта одинаковы. Реакция эфира карбоновой кислоты (R = Alk) с 1 молем реактива Гриньяра приводит к кетону (какому?), который, в свою очередь, вступает в реакцию с ещё 1 эквивалентом реактива Гриньяра и даёт конечный продукт. Эфир карбоновой кислоты легко получить реакцией карбоновой кислоты и спирта при кислотном катализе (см. выше химические свойства спиртов). Дальше синтез трудностей вообще не представляет.
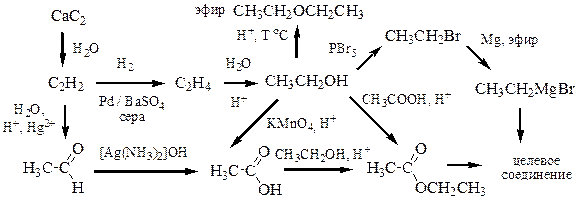
Задания для самостоятельной работы
7.1 Изобразите структурные формулы нескольких изомеров приведённого спирта, проиллюстрировав различные возможные виды изомерии (назовите их), характерные для спиртов. Назовите все соединения по правилам международной номенклатуры.
а). 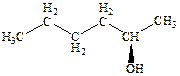 б)
б) 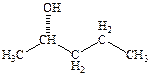
7.2 Назовите приведённые соединения согласно правилам номенклатуры IUPAC
. 
Соединения, для которых пригодно употребление рациональной номенклатуры спиртов, назовите согласно её правилам.
7.3 Восстановите структурную формулу соединения по названию:
3,5,5,7-тетраметилоктанол-4; 2,5-диметилциклогексанол; втор -бутиловый спирт; диметилфенилкарбинол; метил трет -бутилкарбинол; 2-хлор-3-метилбутандиол-1,4; 2‑метил-3-этилгексантриол-1,3,4.
7.4 Расположите в порядке убывания кислотности следующие соединения:
Пропанол-1, Пропанол-2, Вода, 2-Хлорэтанол. Ответ обоснуйте.
7.5 Какой из спиртов – этанол или 2,2,2-трифторэтанол – обладает большей основностью? Ответ обоснуйте.
7.6 Напишите уравнения реакций
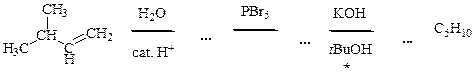
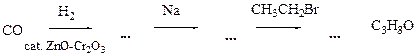
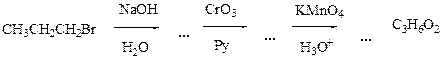
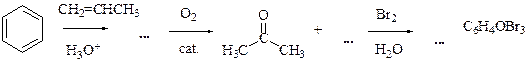
7.7 Напишите уравнения реакций
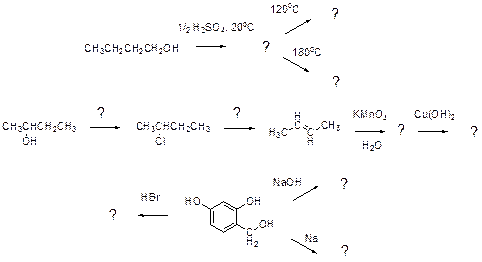
7.8 Напишите уравнения реакций к схеме. По какому механизму протекает реакция, отмеченная звёздочкой? Будет ли продукт этой реакции оптически активным?

7.9 На нейтрализацию раствора, содержащего уксусную кислоту и фенол, было истрачено 12,25мл 2М раствора гидроксида натрия. Такое же количество раствора может прореагировать с 167,80г 3% бромной воды. Определите массовые доли веществ в смеси, напишите уравнения реакций.
7.10 При нагревании предельного одноатомного спирта с бромоводородной кислотой образуется соединение, массовая доля брома в котором составляет 73,4%. Определите молекулярную формулу исходного спирта.
7.11 Напишите уравнения реакций к схеме, укажите условия их протекания
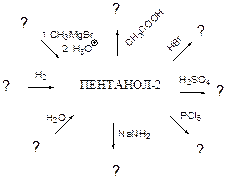
7.12 Напишите уравнения реакций к схеме, укажите условия их проведения:
а) карбид кальция " ацетилен " этилен " этиленгликоль " 1,2-дихлорэтан
б) карбид алюминия " метан " хлорметан " метилмагнийхлорид " 2-метилпропанол-2
в) толуол " бензил бромид[15] " бензиловый спирт " бензойная кислота
7.13 Смесь, содержащая муравьиную кислоту и этиловый спирт, может прореагировать с 4,00г твёрдого гидроксида натрия или с 11,04г натрия. Определите, какое количество сложного эфира (в г) можно получить из этой смеси, если реакция этерификации протекает с 65% выходом. Напишите уравнения всех реакций.
7.14 Определите массовую долю этилата натрия в его спиртовом растворе, полученном растворением 2,3г натрия в 50мл абсолютного этанола (плотность 0,79г/мл). Напишите уравнения реакций, которые будут происходить при добавлении к этому раствору а) соляной кислоты б) 2-бромгексана.
7.15 Раскройте механизм взаимодействия 1,1,1-тридейтеро-2-бром-2-метилбутана с водным разбавленным раствором гидроксида калия. Если субстратом в реакции окажется оптически чистое соединение, будет ли в результате реакции наблюдаться продукт, также обладающий оптической активностью? Какие побочные продукты получаются в этой реакции? Ответ обосновать.
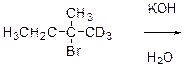
7.16 Получите из неорганических реагентов 3-метилпентанол-2.
7.17 Получите из неорганических реагентов гексанол-2.
7.18 При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200г, массовая доля брома в которой составляла 3,2%. Определите массу пропанола‑2, взятую для реакции.
7.19 При каталитической дегидратации этанола массой 1,84г получили газ, который полностью прореагировал с бромом, содержащимся в 50г 8% раствора брома в хлороформе. Определите выход продукта реакции дегидратации спирта.
7.20 Раскройте механизм взаимодействия 2-метил-1-дейтеробутанола-2 с соляной кислотой. В реакцию вводят оптически активное соединение. Будет ли в результате реакции наблюдаться продукт, обладающий оптической активностью, или смесь равных количеств двух оптических изомеров, не обладающая оптической активностью (рацемат)? Какие продукты реакции могут быть побочными? Ответ обосновать.
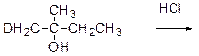
7.21 При действии натрия на 13,8 г смеси этанола и одноосновной предельной карбоновой кислоты выделилось 3,36 г газа (н.у.), а при действии на ту же смесь избытка гидрокарбоната натрия – 1,12 л газа (н.у.). Определите строение кислоты.
7.22 Из неорганических реагентов получите 1,2,3‑бутантриол.
7.23 Предложите не менее четырёх реакций, посредством которых можно получить метиловый спирт. Укажите исходные соединения, реагенты, условия реакции.
7.24 Предложите не менее четырёх реакций, посредством которых можно получить этиловый спирт. Укажите исходные соединения, реагенты, условия реакции.
7.25 Как Вы помните, в начале раздела было сказано, что двухатомные спирты, в молекулах которых две гидроксильные группы связаны с одним атомом углерода (геминальное расположение), как правило, неустойчивы и подвергаются дегиратации с образованием карбонильных соединений. Подумайте, какие условия необходимы для того, чтобы подобный диол оказался преобладающим в смеси с карбонильным соединением.
7.26 Паша и Наташа обнаружили, что у пяти бутылей с бесцветными жидкостями отклеились этикетки.
– Ого! Литров по 5 каждая! Жалко, что мы не знаем, что это такое, – сказал Паша.
– Этикетки были, просто отклеились. Давай их поищем, – предложила Наташа.
Этикетки удалось обнаружить: «Этанол, водный р-р», «Фенол, водный р-р», «Вода дистиллированная», «Соляная кислота, 5% р-р», «Этиленгликоль, водный р-р».
– Здорово! Осталось только понять, какая этикетка откуда, но как это сделать?
– Проведем анализ, – авторитетно заявил Паша.
Представьте себя на месте наших героев. Опишите, как бы Вы себя вели и что бы Вы делали, чтобы определить содержимое каждой бутыли.
Какие вещества, в каком количестве потребуются Вам для анализа? Напишите уравнения реакций, укажите наблюдаемые изменения.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3125; Нарушение авторских прав?; Мы поможем в написании вашей работы!