
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сравнение видов химической связи
Примеры электронных формул атомов
| Атом | Полная | Сокращенная | Валентная |
| Водород H | 1s1 | - | 1s1 |
| Азот N | 1s2 2s2 2p3 | 2s2 2p3 | 2s2 2p3 |
| Хлор Cl | 1s2 2s2 2p33s23p5 | 3s23p5 | 3s23p5 |
| Марганец Mn | 1s2 2s2 2p33s23p64s23d5 | 4s23d5 | 4s23d5 |
| Мышьяк As | 1s2 2s2 2p33s23p64s23d104p3 | 4s23d104p3 | 4s24p3 |
| Криптон Kr | 1s2 2s2 2p33s23p64s23d104p6 | 4s23d104p6 | 4s24p6 |
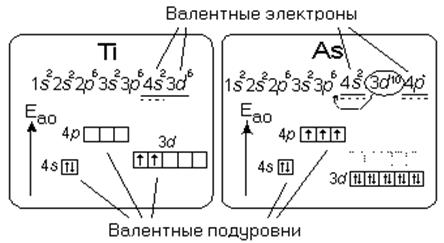
Рис.3.1. Валентные подуровни и валентные электроны атомов титана и мышьяка.
У s- и p- элементов валентными являются электроны внешнего слоя (ns2np6), у d- элементов валентными являются электроны s- состояния внешнего слоя и d – состояния предвнешнего слоя (ns2(n-1)d10), у f- элементов (лантаноиды и актиноиды) электроны f- состояния не являются валентными и в химической связи не участвуют.
Для описания химической связи в веществе необходимо знать распределение электронной плотности атомов. В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую.
Таблица 3.2.
| Сравниваемые признаки | Виды химической связи | ||
| Ковалентная | Ионная | Металлическая | |
| Способ образования связи | Образование общих электронных пар | Взаимное притяжение разноименно заряженных ионов | Притяжение ионов металлов и свободных электронов |
| Характер участвующих в образовании связи частиц (атомы или ионы) | Преимущественно атомы неметаллов | Преимущественно ионы металлов и неметаллов | Ионы металлов и свободные электроны |
| Строение твердых веществ | Молекулярные или атомные кристаллические решетки | Ионный кристалл (ионная кристаллическая решетка) | Кристалл металла (металлическая кристаллическая решетка) |
Ионная связь – это электростатическое взаимодействие между ионами с зарядами противоположного знака. Ионная связь образуется в результате значительного переноса электронной плотности от одного атома к другому. Такой тип связи возможен только между атомами, которые резко отличаются по свойствам (типичные металлы с низким потенциалом ионизации соединяются с типичными неметаллами с большим сродством к электрону).
Ионная связь в отличие от ковалентной характеризуется ненаправленностью и ненасыщенностью связи. Обладая силовым полем, каждый ион может притягивать к себе ионы противоположного знака в любом направлении. Данные свойства обуславливают склонность ионных молекул к соединению их друг с другом. Энергетически наиболее выгодно, когда каждый электрон окружен максимальным числом ионов противоположного знака. Однако, из-за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной координации ионов. В обычных условиях ионные соединения имеют кристаллическую решетку, в которой каждый ион окружен несколькими ионами противоположного знака, где все связи равноценны, так что весь кристалл можно рассматривать как единую молекулу.
В качестве примеров можно привести MgS, NaCl, которые при обычных условиях являются твердыми веществами, имеют высокие температуры плавления и кипения, их расплавы или растворы проводят электрический ток.
Металлическая связь. Большинство металлов обладают рядом свойств, имеющих общий характер, и отличающийся от свойств других простых или сложных веществ. Это высокие температуры плавления, способность к отражению света, высокая тепло и электропроводность. Эти особенности обязаны существованию в металлах особого вида связи – металлической связи. Атомы металлов имеют небольшое число валентных электронов, которые слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
В случае металлов нельзя говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Этим объясняется пластичность металлов, т.е. возможность смещения ионов и атомов в любом направлении без нарушения связи.
В результате эксперимента было установлено, что образование химической связи возможно только при противоположных спинах электронов, образующих неразрывную общую пару. Такая химическая связь (двухэлектронная двухцентровая) получила название ковалентной.
|
|
Дата добавления: 2014-11-07; Просмотров: 2865; Нарушение авторских прав?; Мы поможем в написании вашей работы!