
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Краткая теория. Цель работы: ознакомление с понятием энтропии и определение ее изменения в реальной системе
ОПРЕДЕЛЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ В ЗАМКНУТОЙ СИСТЕМЕ
Цель работы: ознакомление с понятием энтропии и определение ее изменения в реальной системе.
Приборы и принадлежности: калориметр, полиэтиленовый стакан, пинцет, нагреватель, термометр, весы, тела из различных материалов.
Наблюдение процессов в природе и технике показывает, что протекание их в противоположных направлениях приводит к существенно различным результатам. Примерами могут служить нагревание и охлаждение тел, смешивание и разделение растворов, заряд и разряд аккумуляторов и т. д.
Важной характеристикой протекания процессов является их обратимость. Обратимым называется процесс, для которого возможен обратный переход из конечного состояния в начальное через те же промежуточные состояния, что и в прямом процессе, но без изменения состояния окружающей среды. Процессы, не удовлетворяющие этому определению, называются необратимыми.
Рассмотрим несколько примеров.
1. Колебания маятника в отсутствие затухания есть полностью обратимый процесс. Если на маятник действуют силы трения, процесс становится необратимым, т.к. часть механической энергии маятника при каждом колебании переходит в тепловую. Можно заставить колебаться маятник сколь угодно долго, однако для этого необходимо пополнять энергию системы извне, действуя внешней силой и совершая работу.
2. При смешивании химического соединения с растворителем наблюдается диффузия растворенного вещества, приводящая к выравниванию его концентрации во всех частях растворителя. Это необратимый процесс, т.к. обратный процесс - самопроизвольного сбора растворенного вещества в какой-либо части растворителя - не наблюдается никогда. Для сбора растворителя необходимо воздействовать на систему извне, совершая при этом работу: например, испарить растворитель.
3. Пусть в состав изолированной системы входят два тела, нагретых до различной температуры. Тогда в системе самопроизвольно начнется процесс перехода энергии от более нагретого тела к менее нагретому телу, и никогда самопроизвольно не будет происходить обратный процесс. Передача тепла от менее нагретого к более нагретому телу возможна только при выполнении работы над системой.
Можно утверждать, что механические процессы, не сопровождающиеся диссипацией (рассеянием) механической энергии, обратимы, а процессы в системах с большим количеством частиц (макросистемах) всегда необратимы.
Определение основных параметров состояния системы (давления р, объема V и температуры Т) не позволяет ответить на вопрос, обратим ли процесс и в каком направлении он может происходить. Нельзя выяснить вопрос об обратимости и возможном направлении протекания процесса и из первого начала термодинамики:
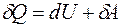 , (1)
, (1)
т.к. приращение внутренней энергии dU есть полный дифференциал, а внутренняя энергия U естьфункция состояния системы (ее изменение зависит только от температуры системы в начальном и конечном состоянии и не зависит от пути перехода), работа же зависит от того, посредством какого процесса система переходит из одного состояния в другое. Другими словами, работа А и количество теплоты Q являются характеристиками не отдельного состояния системы, а совершаемого ею процесса.
Для выяснения вопроса об обратимости и направлении протекания процессов в термодинамике наряду с основными параметрами р, V, T вводится энтропия S – такая функция состояния термодинамической системы, дифференциал которой dS в элементарном обратимом процессе равен отношению бесконечно малого количества теплоты 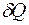 , сообщенного системе, к абсолютной температуре Т системы:
, сообщенного системе, к абсолютной температуре Т системы:
 . (2)
. (2)
Из (2) следует, что физический смысл имеет только изменение энтропии, для
макроскопических процессов оно равно
 , (3)
, (3)
где S 2, S 1 – энтропия в конечном и начальном состоянии системы соответственно.
За нуль энтропии может быть выбрано ее значение для системы в любом исходном состоянии. Практически за нуль энтропии выбирают ее значение для системы при абсолютном нуле температуры.
Энтропия – величина аддитивная: энтропия макросистемы равна сумме энтропий ее отдельных частей:
 . (4)
. (4)
Больцман показал, что энтропия системы зависит от вероятности 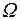 реализации данного состояния системы:
реализации данного состояния системы:
 (5)
(5)
где термодинамическая вероятность 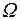 определяет число микросостояний, соответствующих одному макросостоянию системы; k = 1,38·10-23 Дж/К – постоянная Больцмана.
определяет число микросостояний, соответствующих одному макросостоянию системы; k = 1,38·10-23 Дж/К – постоянная Больцмана.
Под макросостоянием понимается задание определенных значений макропараметров системы (например, р, V, T). Под микросостоянием понимается каждое конкретное распределение микрочастиц системы по положению (координатам) и скоростям.
Замкнутой (изолированной) называется термодинамическая система, которая не обменивается ни энергией, ни веществом с другими системами.
В соответствии со вторым началом термодинамики при любых процессах в замкнутой системе энтропия не убывает:
Δ S = S 2 – S 1 ³ 0, (6)
где S 2, S 1 – энтропия в конечном и начальном состоянии системы соответственно.
При обратимых процессах ΔS = 0, при необратимых ΔS > 0.
Из сравнения (5) и (6) следует, что в любых процессах в замкнутой системе вероятность конечного состояния не меньше вероятности начального состояния.
Это утверждение не является абсолютным. Оно указывает лишь наиболее вероятное направление протекание процессов. Однако расчеты и опыт показывают, что вероятность протекания процессов в противоположном направлении настолько незначительна, что такую возможность просто нет смысла учитывать.
Таким образом, расчет изменения энтропии позволяет выяснить направление протекания процесса в ней. Для определения энтропии системы можно воспользоваться ее связью с другими термодинамическими параметрами – давлением р, объемом V, температурой T, которые могут быть определены в эксперименте.
При передаче тепла от одного тела к другому, когда работа не совершается (например, при изохорном процессе в идеальном газе), элементарное количество теплоты
 = сmdT, (7)
= сmdT, (7)
где с – удельная теплоемкость вещества, m - масса тела. Тогда изменение энтропии в данном процессе в соответствии с (3) равно
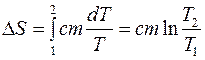 , (8)
, (8)
где Т 1, Т 2 - температура тела начальном и конечном состоянии соответственно.
В лабораторной работе необходимо определить изменение энтропии замкнутой системы, включающей калориметр, воду, испытуемое тело и термометр, при теплообмене между ними. Пусть калориметр, вода и термометр в начале опыта имеют температуру Т 1, испытуемое тело – Т 2, а по достижении теплового равновесия устанавливается одинаковая для всех них температура Т 0.
В соответствии с (8) изменения энтропии калориметра Δ S к, воды Δ S в, тела Δ S т и термометра Δ S тм равны:
Δ S к = с к m к ; Δ S в = с в m в
; Δ S в = с в m в ; Δ S т = с т m т
; Δ S т = с т m т ; Δ S тм = с тм m тм
; Δ S тм = с тм m тм , (9)
, (9)
где m тм, с тм – масса и удельная теплоемкость термометра соответственно.
В соответствии со свойством аддитивности (4) изменение энтропии системы равно
Δ S = Δ S к + Δ S в + Δ S т +Δ S тм. (10)
Установившуюся в результате теплообмена температуру Т 0 в системе можно рассчитать с помощью уравнения теплового баланса
Δ Q к + Δ Q в + Δ Q т +Δ Q тм = 0, (11)
из которого с учетом (7) имеем:
с к m к (Т 0 – Т 1) + с в m в (Т 0 – Т 1)+ с т m т (Т 0 – Т 2) + с тм m тм (Т 0 – Т 1) = 0, (12)
откуда
 . .
| (13) |
|
|
Дата добавления: 2014-10-15; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!