
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислород и его соединения
|
|
|
|
Лекция № 20. Элементы VIA-подгруппы
В главную подгруппу VI группы (подгруппу VIA) входят следующие элементы: кислород - О, сера - S, селен - Se, теллур - Te и полоний - Po. Общая электронная формула их атомов - ns2np4. Отсутствие энергетически доступных d-орбиталей и высокая электроотрицательность атома кислорода обусловливает его отличия от остальных элементов подгруппы. Для него характерна степень окисления -2; соединения в других степенях окисления представлены единичными примерами: 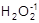 ,
, 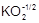 , O2+1F2, O2+F2. Для серы и элементов подгруппы селена наряду со степенью окисления -2 возможны положительные степени окисления, в основном +4 и +6. Увеличение эффективного радиуса атома при переходе от серы к полонию сопровождается уменьшением электроотрицательности элемента и усилением металлического характера простых веществ.
, O2+1F2, O2+F2. Для серы и элементов подгруппы селена наряду со степенью окисления -2 возможны положительные степени окисления, в основном +4 и +6. Увеличение эффективного радиуса атома при переходе от серы к полонию сопровождается уменьшением электроотрицательности элемента и усилением металлического характера простых веществ.
Кислород - самый распространенный элемент земной коры (58 мол.%). В природе представлен тремя изотопами: 16O, 17O (0,04%), 18O(0,2%). В виде простого вещества входит в состав атмосферы (20,9 об.% или 23,2 мас. %). Значительная часть элемента кислород входит в состав воды гидросферы, многих руд и минералов (оксиды, сульфаты, карбонаты, силикаты и т.д.).
Элемент кислород образует два простых вещества, аллотропные модификации, отличающиеся составом молекул - кислород (О2) и озон (О3). Вещество кислород представляет собой бесцветный газ без вкуса и запаха. При температуре -183 °С кислород сжижается, образуя подвижную жидкость голубого цвета, которая кристаллизуется при - 219 ° с образованием кристаллов синего цвета. Играет важную биологическую роль, обеспечивая процессы дыхания.
Озон образован трехатомными молекулами, строение которых можно представить следующей схемой:
|
|
|
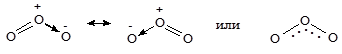
Несмотря на то, что озон - простое вещество, часто его рассматривают как соединение кислорода в степени окисления +4 - O4+O2-2. Озон - газ синего цвета с резким раздражающим запахом, т.кип. -112 °С, очень токсичен - предельная допустимая концентрация в воздухе (ПДК) 0,16 мг/м3. В малых концентрациях озон обладает обеззараживающим действием. В природе образуется при грозовых разрядах и в верхних слоях атмосферы при действии на молекулярный кислород жесткого ультрафиолетового облучения:
hn
3О2 = 2О3
Основное количество озона, образующегося в природных условиях, расположено в верхних слоях атмосферы на высоте 20-30 км, образуя так называемый "озоновый экран". В приземных слоях атмосферы содержание озона составляет 10-7-10-6%. Содержание озона в озоновом экране таково, что при атмосферном давлении он образовал бы слой газа толщиной около 1 см. Несмотря на малую концентрацию, озон играет очень важную биологическую роль, задерживая губительное для всех форм жизни жесткое ультрафиолетовое излучение. В последние годы возникла угроза целостности озонового экрана, разрушаемого при попадании в верхние слои атмосферы фреонов, которые широко применяются в качестве хладагентов в бытовых холодильниках и аэрозольных упаковках.
Получение. В промышленности кислород получают фракционной перегонкой (ректификацией) жидкого воздуха. Лабораторные методы получения кислорода основаны на термическом разложение веществ, богатых кислородом - KMnO4, KClO3, H2O2 и т.п.
t
2KMnO4 ¾® K2MnO4 + MnO2 + O2
t
2KClO3 ¾® 2KCl + 3O2
В лабораторных условиях озон получают при действии на кислород слабого (тлеющего) электрического разряда. При этом образуется смесь, содержащая 20-30% озона - озонированный кислород.
Химические свойства. По химическим свойствам кислород один из наиболее активных неметаллов, реагирующий с большинством простых веществ. Соответствующие реакции будут рассмотрены при изучении химии других элементов и их соединений. Непосредственно с кислородом не взаимодействуют только инертные газы, галогены и благородные металлы (серебро, золото и платина).
|
|
|
Озон по химическим свойствам напоминает кислород, однако отличается большей активностью. Например, озон при обычных условиях окисляет малоактивные металлы:
8Ag + 2O3 = 4Ag2O + O2
Качественной реакцией на озон является посинение бумаги, смоченной иодидом калия и крахмалом (иодокрахмальная бумага), за счет образования иода при окислении KI.
2KI + O3 + H2O = I2 + 2KOH + O2
Применяется озон для дезинфекции воздуха и воды, а также как эффективный окислитель в химическом синтезе.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!