
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа
|
|
|
|
Главное квантовое число – n -определяет энергию электрона на энергетическом уровне и размер атомной орбитали. Принимает целочисленные, положительные значения: 1, 2, 3, …+ ∞.
Энергетический уровень – это совокупность электронов с одинаковым значением главного квантового числа n. Чем больше значение n, тем больше энергия электрона и размер орбитали. Число энергетических уровней в атоме равно номеру периода в периодической системе Д.И. Менделеева.
Например: элемент алюминий 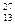 Al находится в III группе периодической системы, следовательно, главное квантовое число n =3, а 13 электронов атома алюминия распределяются по трем энергетическим уровням.
Al находится в III группе периодической системы, следовательно, главное квантовое число n =3, а 13 электронов атома алюминия распределяются по трем энергетическим уровням.
Орбитальное квантовое число – ℓ - определяет запас энергии электрона на энергетическом подуровне, а также форму атомной орбитали. Орбитальное квантовое числозависит от n и может принимать значения от 0 до (n- 1).
Энергетический подуровень составляют электроны с определенным значением ℓ. Каждому цифровому значению ℓ соответствует буквенное обозначение подуровня и определенная форма атомной орбитали:
| Значение ℓ | ||||||
| Подуровень | s | p | d | f | g | h |
| Форма атомной орбитали | 
| 
| 
| сложные формы |
Связь главного квантового числа с орбитальным определяет число подуровней на энергетическом уровне:
| уровень | n | ℓ | число подуровней |
| 1 (s подуровень) | |||
| 0,1 | 2 (s, p) | ||
| 0,1,2 | 3 (s, p, d) | ||
| 0,1,2,3 | 4 (s, p, d, f) |
Магнитное квантовое число – m -характеризует пространственное расположение орбиталей и определяет число их на подуровне. Принимает значения от –ℓ,… 0,… до + ℓ.
Обозначим атомную орбиталь в виде квантовой ячейки □ и рассмотрим связь m с орбитальным квантовым числом ℓ.
|
|
|
| подуровень | ℓ | m | число орбиталей на подуровне | |||||||
| s | ||||||||||
| p | -1, 0, +1 | |||||||||
| d | -2, -1, 0, +1, +2 | |||||||||
| f | -3, -2, -1, 0,+1, +2, +3 |
Спиновое квантовое число (спин) – s -показывает собственное вращение электрона вокруг своей оси, которое может быть по- или против часовой стрелки. Спиновое квантовое числопринимает значения 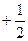 или
или  .
.
Например: определить положение в атоме электрона, имеющего следующие значения квантовых чисел n=3, ℓ =1,m =-1, s= -1/2
3р1 - 3 уровень(n=3), р-подуровень(ℓ =1)
| ↓ |
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 3077; Нарушение авторских прав?; Мы поможем в написании вашей работы!