
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Распределение электронов по уровням, подуровням и орбиталям во многоэлектронном атоме
|
|
|
|
Распределение характеризуется следующими правилами:
· принципом Паули;
· правилом Гунда;
· принципом наименьшей энергии и правилом Клечковского.
По принципу Паули в атоме не может быть двух и более электронов с одинаковым значением всех четырех квантовых чисел. Основываясь на принципе Паули можно установить максимальную емкость каждого энергетического уровня и подуровня.
| № уровня | Подуровень, ℓ | обозначение подуровня | магнитное квантовое число, m | спиновое квантовое число, s |
| n=1 | 1s | 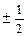
| ||
| n=2 | 2s 2p | -1, 0, 1 | 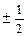
| |
| n=3 | 3s 3p 3d | -1, 0, 1 -2,-1, 0, 1, 2 | 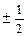
| |
| n=4 | 4s 4p 4d 4f | -1, 0, 1 -2,-1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 | 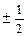
|
Таким образом, максимальное количество электронов на:
s-подуровне – 2,
p- подуровне – 6,
d-подуровне – 10,
f-подуровне – 14.
В пределах квантового уровня n электрон может принимать значения 2n2 различных состояний, что было установлено опытным путем с помощью спектрального анализа.
Правило Гунда: в каждом подуровне электроны стремятся занять максимальное число свободных энергетических ячеек, чтобы суммарный спин имел наибольшее значение.
Например:
правильно неправильно неправильно
| ↑ | ↑ | ↑ |
| ↓ | ↑ | ↓ |
| ↓↑ | ↑ |
3р3:
s = +1/2+1/2+1/2=1,5 s =-1/2+1/2+1/2=0,5 s = -1/2+1/2-1/2=-0,5
Принцип наименьшей энергии и правило Клечковского: электроны в первую очередь заселяют квантовые орбитали с минимальной энергией. Так как запас энергии в атоме определяется значением суммы главного и орбитального квантовых чисел (n + ℓ), то сначала электроны заселяют орбитали, для которых сумма (n + ℓ) наименьшая.
Например: сумма (n + ℓ) для 3d - подуровня равна n = 3, l = 2, следовательно, (n + ℓ) = 5;
|
|
|
для 4s-подуровня: n = 4, ℓ = 0, следовательно, (n + ℓ) = 4. В этом случае в первую очередь заполняется 4s-подуровень и только потом 3d-подуровень.
Если суммарные значения энергии равны, то заселяется тот уровень, который находится ближе к ядру.
Например: для 3d: n = 3, ℓ = 2, (n + ℓ) = 5;
для 4p: n = 4, ℓ = 1, (n + ℓ) = 5.
Так как n = 3 < n = 4, 3d заселится электронами раньше, чем 4 p.
Таким образом, последовательность заполнения уровней и подуровней электронами в атомах:
1s2<2s2<2p6<3s2<3p6<4s2<3d10<4p6<5s2<4d10<5p6<6s2<5d10≈4f14<6p6<7s2…..
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2349; Нарушение авторских прав?; Мы поможем в написании вашей работы!