
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость химических реакций
|
|
|
|
Кинетическая классификация химических реакций
Кинетика химических реакций
Термодинамика прогнозирует только возможность и невозможность процесса, но не говорит, как быстро будет идти реакция. Цель кинетики – прогноз протекания реакций во времени. Важнейшим понятием химической кинетики является скорость химической реакции. Под скоростью химической реакции понимают изменение концентрации реагирующих веществ или продуктов реакции в единицу времени. Скорость реакции рассчитывается как изменение концентрации реагирующих веществ в определённый промежуток времени:
 .
.
По числу молекул, принимающих участие в элементарном акте, реакции классифицируют на моно-, би- и тримолекулярные.
Мономолекулярными называются такие реакции, в которых химическому превращению подвергается одна молекула:

Кинетическое уравнение скорости для этого типа реакции имеет вид:

Бимолекулярные – такие реакции, в которых в элементарном акте встречаются две молекулы:
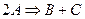
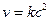

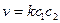
Тримолекулярные – реакции, в элементарном акте которых участвуют три молекулы (такие реакции встречаются редко):


В кинетике различают реакции нулевого, первого, второго, третьего и дробного порядков. Порядок реакции – это число, равное сумме показателей степеней концентраций реагирующих веществ в основном кинетическом уравнении. Для процесса, описываемого уравнением:

сумма показателей степеней равна 2 + 1 = 3, то есть это реакция третьего порядка.
Для простых по механизму реакций величины молекулярности и порядка совпадают, но для сложных реакций порядок не соответствует молекулярности. Такое несоответствие может быть вызвано большим избытком одного из реагентов. Например, при гидролизе сахарозы:
|
|
|

изменение концентрации воды так незначительно, что его можно не учитывать. Тогда основное кинетическое уравнение реакции можно записать:
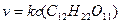
Следовательно, реакция гидролиза сахарозы является бимолекулярной реакцией первого порядка.
Скорость химической реакции зависит от многих факторов, включая природу реагирующих веществ, концентрацию реагирующих веществ, температуру, наличие катализаторов. Рассмотрим эти факторы.
1). Природа реагирующих веществ. Если идёт взаимодействие между веществами с ионной связью, то реакция протекает быстрее, чем между веществами с ковалентной связью.
2.) Концентрация реагирующих веществ. Чтобы прошла химическая реакция, необходимо столкновение молекул реагирующих веществ. То есть молекулы должны настолько близко подойти друг к другу, чтобы атомы одной частицы испытывали на себе действие электрических полей другой. Только в этом случае будут возможны переходы электронов и соответствующие перегруппировки атомов, в результате которых образуются молекулы новых веществ. Таким образом, скорость химических реакций пропорциональна числу столкновений, которое происходит между молекулами, а число столкновений, в свою очередь, пропорционально концентрации реагирующих веществ. На основании экспериментального материала норвежские учёные Гульдберг и Вааге и независимо от них русский учёный Бекетов в 1867 году сформулировали основной закон химической кинетики – закон действующих масс (ЗДМ): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Для общего случая:

закон действующих масс имеет вид:
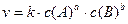
Запись закона действующих масс для данной реакции называют основным кинетическим уравнением реакции. В основном кинетическом уравнении k – константа скорости реакции, которая зависит от природы реагирующих веществ и температуры.
|
|
|
Большинство химических реакций является обратимыми. В ходе таких реакций продукты их по мере накопления реагируют друг с другом с образованием исходных веществ:

Скорость прямой реакции:

Скорость обратной реакции:
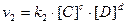
В момент равновесия:
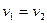

Отсюда закон действующих масс в состоянии равновесия примет вид:
 ,
,
где K – константа равновесия реакции.
3) Влияние температуры на скорость реакции. Скорость химических реакций, как правило, при превышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом.
2Н2 + О2 = 2Н2О
При 200С скорость реакции практически равна нулю и понадобилось бы 54 млрд.лет, чтобы взаимодействие прошло на 15%. При 5000С для образования воды потребуется 50 минут, а при 7000С реакция протекает мгновенно.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при увеличении температуры на 10о скорость реакции увеличивается в 2 – 4 раза. Правило Вант-Гоффа записывается:

4) Влияние катализаторов. Скорость химических реакций можно регулировать с помощью катализаторов – веществ, изменяющих скорость реакции и остающихся после реакции в неизменном количестве. Изменение скорости реакции в присутствии катализатора называется катализом. Различают положительный (скорость реакции увеличивается) и отрицательный (скорость реакции уменьшается) катализ. Иногда катализатор образуется в ходе реакции, такие процессы называют автокаталитическими. Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе. Например:
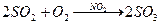
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Например:

Гетерогенный катализ связан с ферментативными процессами. Все химические процессы, протекающие в живых организмах, катализируются ферментами, которые представляют собой белки с определёнными специализированными функциями. В растворах, в которых идут ферментативные процессы, нет типичной гетерогенной среды, в связи с отсутствием чётко выраженной поверхности раздела фаз. Такие процессы относят к микрогетерогенному катализу.
|
|
|
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1325; Нарушение авторских прав?; Мы поможем в написании вашей работы!