
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1. Параметры (показатели) водных режимов
|
|
|
|
1.1. Показатели ВР.
Эти показатели изучались нами в курсе тепловые сети и их
водные режимы. Обычно они составляют нормы ведения водного режима не зависимо от устройств.
Нормы - это совокупность выявленных практикой параметров, которые обеспечивают надежную и длительную эксплуатацию энергоблоков электростанций.
Организовать водный режим это значит строго выдерживать нормы водного режима.
Среди показателей ВР есть фундаментальные, найболее употребляемые: это рН, удельная электропроводность и величина, которая появилась в последнее время - редокспотенциал, или окислительно-восстановительный потенциал еН. Главное достоинство этих показателей - это возможность их автоматизированного измерения, подобно давлениюи температуре.
Дополнительными показателями являются:
- жёрсткость (твёрдость);
- щелочность;
- концентрация Cl- іона,
- концентрация SiO2,
- концентраця кислорода,
- концентрации других газов СО2, Н2,NH3,
-концентрации других примесей, которые используются для коррекции водного режима: фосфаты, гидразин, комплексоны, и др..
Что такое рН? Формальный ответ – отрицательный десятичный логарифм мольной концентрации (активности) ионов водорода. Однако, и это очень важно, это понятие связано с законом действующих масс, а также с причинами, которые вызывают появление ионов водорода в воде. Этих причин две: диссоциация самой воды и диссоциация других соединений (в первую очередь кислот и щелочей, которые присутствуют в водном растворе, а также гидролиз соединений).
Диссоциация в воде имеет место всегда, независимо от того или это чистая вода, или это раствор какого-то соединения. Для понятия рН важно знание численного значения, которое соответствует нейтральному состоянию:
|
|
|
рНо=1/2рКw (1.1)
В этом уравнении индекс «о» при Н означає нейтральность, индекс р – отрицательный десятичный логарифм.
Уравнение (1.1) показывает связь понятия нейтрального значения рНо из понятием ионного произведения воды, вместе с тем свидетельствует о том, что нейтральность воды(растворов) при разных температурах и давлениях характеризуется разными числовыми значениями величины рНо, причем при температуре около 250 оС рНо достигает минимуму. Если при 25 оС рНо = 7, то при 250 оС эта величина снижается почти до 5,5.
Какие причины могут вызвать на ТЭС и АЭС отличие рН теплоносителя от нейтрального? Во-первых это наличие СО2. во-вторых, это разложение при повышенных температурах органических примесей. Эти факторы чаще всего вызывают снижение рН. Разложение бикарбонатов и гидролиз солей могут вызвать повышение рН. Корректируют рН в сторону его повышения с помощью аммиака или других аминов (морфолина, пиперидина, гидразина).
Понятие удельной электропроводности - χ, мкСм/ см заимствуется из электротехники с тем отличием, что в растворах носителями тока выступают ионы. Удельная электропроводность завист от температуры, характер этой зависимости рассмотрен ранее.
Что таке еН?
еН - это окислительно-восстановительный потенциал, который может буть рассчитан по уравнению Нернста:
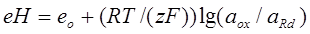 , (1.2)
, (1.2)
где аox и аRd - активности (концентрации) соответственно ионов, которые ркислились и ионов, которые восстановились;
z –заряд;
F =96,485 103 Кл –постоянная Фаррадея;
R- газовая постоянная;
T- температура;
eo- стандартный (нормальный) окислительно-восстановительный потенциал системы.
Показатель еН прежде всего нужен для прогноза и предупреждения коррозии.
Другие показатели ВР являются традиционными для оценки качества водных растворов.
1.2.Растворимость твердых примесей в воде
|
|
|
Растворимостью (S) называют предельную клнцентрацию примеси в растворе в условиях ёё равновесия с нерастворённым твёрдым веществом.
Растворимость может быть выражена какой-либо единицей концентрации. Растворимость зависит от температуры.
На отдельных участках тепловой схемы АЭС теплоноситель имеет различное название. Это связано не только с термическим состоянием воды, но также с ёё качественным составом. С этой точки зрания различают:
- конденсат;
- питательную воду;
- дренажи конденсата;
- охлаждающую воду в конденсаторе;
- продувочную воду;
- воду теплосети
- воду первого контура.
Примеси вод АЭС возможно разделить на природные, которые проникнают в контур с природной водой, и искуственные, которые являются продуктами коррозии и коррекции водного режима.
Где проникают природные примеси:
- в конденсаторе;
- в подогревателях тепловой сети;
- с добавочной водой;
- из воздуха.
Что это за примеси? Продукты дисоциации разных веществ: катионы - Na+, K+, Ca2+, Mg2+, анионы - Cl-, SO42-, SiO32-, HCO3-, CO32-; колоидные примеси: SiO2, окислы металла, органические примеси; газовые: О2, СО2, N2 и др.. По тракту за счёт коррозии добавляются Fe, Cu, Al, за счет коррекции - щелочи, комплексоны, амины. В каком состоянии? В виде истинно растворенном, а также в коллоидном и в виде ГДП (грубо дисперсных примесей).
Чтобы не было накипи и она не образовывалась, нужно все время поддерживать примеси в истинно растворимом состоянии. Математически это условие задается неравенством
Cі < Sі, (1.3)
где Cі -концентрация примеси;
Sі - растворимость этой примеси.
По знаку температурного коэффициента растворимости dS/dt, судят опасно ли это вещество как накипеобразователь. Если он отрицателен, то вещество может давать накипь. Из перечисленных примесей соединения Ca и Mg труднорастворимы, и часть из них имеют отрицательный коэффициент растворимости и являются основными накипеобразователями (особенно для котлов низкого и среднего давления). Соединения Ca и Mg с анионами хлора, хорошо растворимы в воде, имеют положительный коэффициент растворимости и опасности не представляют. CaCO3, CaSO4, Mg(OH)2, труднорастворимы и имеют отрицательный коэффициент растворимости и являются наиболее опасными с точки зрения накипеобразования уже при низких температурах используемой воды.
|
|
|

Рис.1.1. Растворимость в воде карбоната кальция и гидрата магния.
Кроме графиков (рис.1.1 и 1.2), которые отражают эксперементальные данные о растворимости индивидуальных веществ, о растворимости веществ можно судить по величине произведения растворимости.
Если известно произведение растворимости то по нему возможно рассчитать растворимость вещества в моль/л по уравнению:
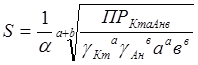 , (1.4)
, (1.4)
где α – степень дисоциации;
а і в – стехиометрические коэффициенты;
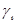 - соответствующие коэффициенты активности ионов.
- соответствующие коэффициенты активности ионов.
Данные о Пр имеются, например, в моем учебнике по ВР.
 |
Рис.1.2. Растворимость разновидностей сульфатов.
При закритических параметрах воды (Р > 22,4 МПа, t > 374 oC) влияние диссоциации на растворимость незначительно, потому что ёё почти нет. Поэтому в таком состоянии воды растворимость примесей описывают иначе чем при низких параметрах и соотношение для растворимости в моль/л имеет вид:
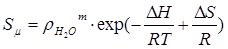 , (1.5)
, (1.5)
де 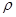 - плотность воды в г/см3 ;
- плотность воды в г/см3 ;
 - изменение энтальпии растворения, Дж/моль;
- изменение энтальпии растворения, Дж/моль;
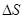 - изменение энтропии растворения, Дж/(моль К);
- изменение энтропии растворения, Дж/(моль К);
m - координационное число.
Как показали исследования, структура (1.5) достаточно хорошо подтверждается для растворимости компонентов в однофазной среде при закритических параметрах. Достаточно надежные результаты получаются также и для воды при высоких давлениях и температурах выше 200 оС.
В дополнение к приведенным данным, для расчетов растворимости окислов железа возможно использовать аппроксимацию даних, имеющихся в литературе
SFe = A1 t2 - B1 t + C1,
где коэффициенты вибирают из табл. 2.5, см. учебник

| Рисунок 2. Растворимость магнетита в кипящей воде в зависимости от ее температуры: 1 — рН=5,0; 2 — рН=5,5; 3 — 2рН=6,0; 4 — рН=7,0. |
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!