
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для второго электрода
|
|
|
|
Для первого электрода
j Ag+/Ag = j ° Ag+/Ag + 0,059 lg 10-1 = 0,799 + 0,059×(–1) = 0,74 В.
j Ag+/Ag = j ° Ag+/Ag + 0,059 lg 10-4 = 0,799 + 0,059×(–4) = 0,563 В.
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле
E = j к – j а = 0,74 – 0,563 = 0,177 В.
Пример 12.2. Рассчитать ЭДС элемента Cd½Cd2+ || Ni2+½Ni при концентрации ионов Cd2+ и Ni2+, равных соответственно 0,1 и 0,001 моль/л.
Решение. Используя уравнения Нернста и данные таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы Cd и Ni:
j Сd2+/Cd = j ° Сd2+/Cd + 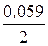 lg 10-3 = –0,403 + 0,0295×(–3) = –0,4915 В;
lg 10-3 = –0,403 + 0,0295×(–3) = –0,4915 В;
j Ni2+/Ni = j ° Ni2+/Ni + 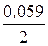 lg 10-1 = –0,250 + 0,0295×(–1) = –0,2795 В.
lg 10-1 = –0,250 + 0,0295×(–1) = –0,2795 В.
Так как j Сd2+/Cd < j Ni2+/Ni, то токообразующей в этом гальваническом элементе является реакция Cd0 + Ni2+ = Cd2+ + Ni0. Рассчитываем ЭДС элемента
E = j Ni2+/Ni – j Сd2+/Cd = –0,2795 – (–0,4915) = 0,212 В.
Пример 12.3. Исходя из значений стандартных электродных потенциалов и D G °х.р., указать, можно ли в гальваническом элементе осуществить реакцию Pb2+ + Ti = Pb + Ti2+. Составить схему гальванического элемента, написать уравнения электродных реакций.
Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом:
(–) Ti½Ti2+|| Pb2+½Pb (+).
Уравнения электродных реакций имеют вид:
на аноде Ti0 – 2ē ® Ti2+
на катоде Pb2++ 2ē ® Pb0
Рассчитываем стандартное значение ЭДС:
E° = j ° к – j ° а = j ° Pb2+/Pb – j ° Ti2+/Ti = –0,126 – (–1,628) = 1,502 B.
Энергию Гиббса рассчитываем по уравнению D G = –nE°F = –2×1,502×96500 = = –289,9 кДж. Так как D G° < 0, токообразующая реакция возможна.
Пример 12.4. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составить молекулярные и ионные уравнения соответствующих реакций.
|
|
|
Решение. В соответствии со значениями стандартных электродных потенциалов ионы меди и свинца по отношению к цинку будут проявлять окислительную активность. При контакте с растворами CuSO4 и Pb(NO3)2 будут протекать реакции растворения цинка и осаждения соответствующего металла:
а) CuSO4 + Zn = Cu + ZnSO4, Cu2+ + Zn = Cu + Zn2+;
б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2, Pb2+ + Zn = Pb + Zn2+.
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка. Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn2+. Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 12.5. Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся при этом гальванических элементов. Определить состав продуктов коррозии.
Решение. Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий
(–0,403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во влажном воздухе – растворенного в воде кислорода.
Анодный процесс Zn – 2ē = Zn2+.
Катодный процесс 2Н+ + 2ē ® Н2 (в кислом растворе);
О2 + 2Н2О + 4ē ® 4ОН– (во влажном воздухе).
Схема образующегося гальванического элемента во влажном воздухе:
(–) Zn | O2, H2O½Cd (+).
Схема образующегося гальванического элемента в кислом растворе:
(–) Zn½HCl½Cd (+).
|
|
|
Во влажном воздухе ионы Zn2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии.
В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn2+.
Пример 12.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (HCl)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии?
Решение. По положению в ряду напряжений металлов видно, что хром более активный металл (j ° Сr3+/Cr = –0,744 В), чем медь (j ° Сu2+/Cu = 0,337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из HCl.
Анодный процесс: Cr –3ē = Cr3+
Катодный процесс в кислой среде: 2Н+ + 2ē ® Н2
Схема гальванического элемента: (–) Cr½HCl½Cu (+)
Появляющиеся ионы Cr3+ образуют с хлорид-анионами (из HCl) растворимое соединение – CrC13, на поверхности меди выделяется Н2.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 314; Нарушение авторских прав?; Мы поможем в написании вашей работы!