
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Галогенангидриды
|
|
|
|
 Галогенангидридами называют сложные вещества, которые можно рассматривать как продукты полного замещения гидроксидных группировок в молекулах оксокислот атомами галогенов. Таким образом, галогенангидриды являются конечным членом ряда последовательных превращений оксокислоты при замещении гидроксидных групп на атомы галогенов: оксокислота ® галогензамещенная оксокислота ® галогенангидрид. Например, POCl3 является конечным членом ряда последовательного замещения трех гидроксидных групп в ортофосфорной кислоте:
Галогенангидридами называют сложные вещества, которые можно рассматривать как продукты полного замещения гидроксидных группировок в молекулах оксокислот атомами галогенов. Таким образом, галогенангидриды являются конечным членом ряда последовательных превращений оксокислоты при замещении гидроксидных групп на атомы галогенов: оксокислота ® галогензамещенная оксокислота ® галогенангидрид. Например, POCl3 является конечным членом ряда последовательного замещения трех гидроксидных групп в ортофосфорной кислоте:
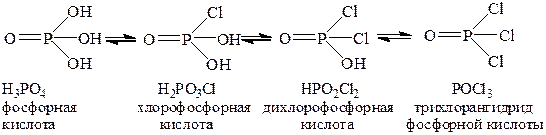
Некоторые галогенангидриды могут быть рассмотрены как производные неустойчивых оксокислот – например, CCl4 и PCl5 формально являются хлорангидридами полностью гидратированных кислотных гидроксидов углерода (IV) H4CO4 и фосфора (V) H5PO5, в которых число гидроксидных групп совпадает со степенью окисления элемента-кислотообразователя. Галогенангидриды могут содержать либо атомы только одного галогена, либо атомы разных галогенов: POCl3, POBrCl2, POIBrCl.
В химической практике для галогенангидридов используют несколько методов построения их названий:
- по правилам систематической номенклатуры для сложных соединений с использованием латинских числовых приставок указывающих количество электроотрицательных галогенидных и оксидных ионов галогенангидрида:
PCl3 - трихлорид фосфора, PCl5 - пентахлорид фосфора,
POCl3 - трихлорид-оксид фосфора, POBrCl2 - дихлорид-бромид-оксид фосфора;
- по правилам систематической номенклатуры для бинарных соединений с указанием по методу Штока римскими цифрами в круглых скобках степени окисления элемента:
|
|
|
PCl3 - хлорид фосфора (III), PCl5 - хлорид фосфора (V);
- традиционные названия образуют с помощью числовых приставок, указывающих количество атомов галогенов, русского названия галогенов, окончания – ангидрид и названия килоты в родительном падеже: PCl3 - трихлорангидрид фосфористой кислоты, POCl3 - трихлорангидрид фосфорной кислоты, POBrCl2 - дихлорбромангидрид фосфорной кислоты;
- для галогеннгидридов серной и сернистой кислоты допускается ограниченное использование специальных названий, в которых применяются специальные названия катионов: SO22+ - сульфурил и SO2+ - тионил:
SO2Cl2 - сульфурилхлорид, SO2FCl - сульфурилхлоридфторид,
SOBr2 - тионилбромид, SOF2 - тионилфторид.
Характерным химическим свойством галогенангидридов является их эффективное взаимодействие с водой с образованием галогеноводородной и оксокислоты:
PCl5 + 3H2O = H3PO4 + 5HCl
POBrCl2 + 3H2O = H3PO4 + 2HCl + HBr
 Упражнения:
Упражнения:
48. Приведите систематические и традиционные названия галогенангидридов и напишите реакции их взаимодействия с водой: SbOCl, SeO2F2, NOBr, NO2F2, NF3, AsOCl2F, CO2Cl2, SOCl2, SO2Br2.
49. Приведите молекулярные и графические формулы галогенангидридов: хлорид-оксид бора, бромид кремния(IV), дифторид-оксид кремния, сульфурилфторид, дихлорангидрид селенистой кислоты, сульфурилбромид, тионилхлорид, хлоробромойодоангидрид ортофосфорной кислоты, дихлоробромоангидрид ортомышьяковой кислоты, тионилфторид.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2308; Нарушение авторских прав?; Мы поможем в написании вашей работы!