
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронное строение алканов
|
|
|
|
Гомологическим рядом метана называется ряд алканов, в котором каждый последующий член отличается от предыдущего на одну метиленовую группу CH2.
| Название углеводорода | Молекулярная формула | Формула строения | Температура (в °C) | |
| плавление | кипение | |||
| Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан И т.д. | C1H4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 | CH4 CH3 – CH3 CH3 – CH2 – CH3 CH3– CH2 – CH2 – CH3 CH3 – (CH2)3 – CH3 CH3 – (CH2)4 – CH3 CH3 – (CH2)5 – CH3 CH3 – (CH2)6 – CH3 CH3 – (CH2)7 – CH3 CH3 – (CH2)8 – CH3 | -182 -183 -187 -138 -130 -95 -91 -57 -54 -30 | -162 -89 -42 -0.5 +36 +69 +98 +126 +151 +174 |
Модели молекул:
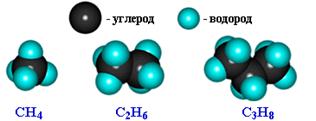
Первые 4 вещества этого ряда имеют исторически сложившиеся названия. Названия углеводородов, начиная с пентана, образованы преимущественно от греческих названий чисел. Для наименования всех предельных углеводородов принят суффикс -ан.
Все предельные углеводороды нерастворимы в воде, но могут растворяться в органических растворителях. Для алканов (начиная с бутана) характерна изомерия скелета: существования множества разветвлённых структур. Число изомеров резко возрастает с увеличением числа атома углерода.
Все связи в молекулах алканов ковалентные неполярные или малополярные. Электронная конфигурация изолированного атома углерода 1s22s22p2. При образовании связи один из 2s-электронов переходит на p-орбиталь, при этом все 4 электронов (2s1 и2p3) становятся энергетически равноценными и занимают 4 одинаковые орбитали. Эти орбитали по способу образования называются sp3-гибридными. В алканах четыре sp3-гибридные орбитали направлены от центрального атома углерода к вершинам тетраэдра с углом между ними около 110 °C – именно в этом случае отталкивание между электронами и энергия системы минимальны.
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 1637; Нарушение авторских прав?; Мы поможем в написании вашей работы!