
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплота утворення та ентальпія
|
|
|
|
Тепловий ефект утворення одного моля будь-якої сполуки з простих речовин називають теплотою утворення. Теплоти утворення простих речовин вважають такими, що дорівнюють нулю, тому тепловий ефект реакції синтезу сполуки з простих речовин дорівнює теплоті утворення цієї сполуки. Якщо речовина існує у кількох алотропних видозмінах, то за нуль приймають теплоту утворення модифікації, яка є стійкою за стандартних умов.
Для зіставлення різних реакцій прийнято порівнювати всі термодинамічні величини, віднесені до одного молю речовини, за стандартних умов. Стандартними умовами у термодинаміці вважають тиск 101,3 кПа та температуру 298 К. Термодинамічні величини та їх зміни, що характеризують речовину у стандартному стані, називають стандартними та позначають за допомогою „0”. Наприклад: теплоти утворення сполук, виміряні за стандартних умов, позначаються Δ H0298..
Із закону Гесса випливає важливий наслідок, який дозволяє розрахувати тепловий ефект хімічної реакції, виходячи з теплот утворення речовин: тепловий ефект реакції ( Δ Н) дорівнює різниці сум теплоти утворення продуктів реакції і вихідних речовин:
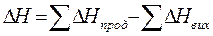
Самочинний перебіг будь-якого процесу — це перехід від упорядкованості до невпорядкованості. Мірою невпорядкованості системи є ентропія (S). Зміна ентропії ( Δ S) характеризує можливість перебігу процесу. Додатне значення Δ S вказує на самовільний перебіг процесу в системі, а від'ємне значення Δ S — на те, що процес може відбуватися лише при затраті певної кількості енергії.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 2066; Нарушение авторских прав?; Мы поможем в написании вашей работы!