
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика и равновесие. Кинетика -учение о скорости различных процессов, в том числе химических
Кинетика -учение о скорости различных процессов, в том числе химических. реакций. Критерием принципиальной осуществимости реакций является неравенство 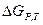 < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так,
< 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, 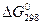 Н20(г) = - 228,59 кДж/моль, a
Н20(г) = - 228,59 кДж/моль, a 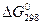 , AlI3(к) = -313,8 кДж/моль и, следовательно, при Т = 298 К и р = 1,013 • 105 Па возможны реакции, идущие по уравнениям:
, AlI3(к) = -313,8 кДж/моль и, следовательно, при Т = 298 К и р = 1,013 • 105 Па возможны реакции, идущие по уравнениям:
H2(г) + 1/202(г) = H20(г) (1)
2А1(к) + 3I2(к)=2АlI3(к) (2)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический "тормоз", и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых — концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в
системе
2S02(г) + 02(г) = 2S03(г)
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие
системы?
Решение. Обозначим концентрации реагирующих веществ: (SO) = а, (О2) = b, (S03)= с. Согласно закону действия масс скорости V прямой и обратной реакции до изменения объема
Vпр = Кa2b; Vобр =KjC 2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится е три раза: (S02) = За, (O2)= 3b (S03) = Зс. При новых концентрациях скорости V' прямой и обратной реакции:
V’пр = К(3а)2 (3b) = 27Ka2b; Vобр = К1 (3с)2 = 9К1с2
Отсюда
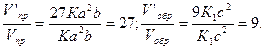
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в.сторону образования S03.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант- Гоффа по формуле:
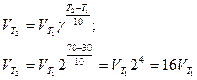
 Следовательно, скорость реакции VT2 при температуре 70°С больше скорости реакции VT1 при температуре 30°С в 16 раз.
Следовательно, скорость реакции VT2 при температуре 70°С больше скорости реакции VT1 при температуре 30°С в 16 раз.
Пример 3. Константа равновесия гомогенной системы
СО (г) + Н2О (г) = СО2 (г) + Н2 (г)
при 8500С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: (СО)ИСХ =3 моль/л, (Н20)ИСХ =2 моль/л.
Решение. При равновесии, скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
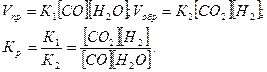
В условии задачи даны исходные концентрации, тогда как в выражение КР входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации (СО2)Р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и H2О расходуется для образования по х молей С02 и Н2. Следовательно, равновесные концентрации всех четырех веществ
|С02]р = [Н2|р.= х моль/л; |СО|р= (3 - x ) моль/л;
 = (2 - х) моль/л.
= (2 - х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:

x2 = 6 - 2x - 3x + x2; 5х = 6, х = 1,2 моль/л.
Таким образом, искомые равновесные концентрации:

Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РС15 (г) = PСl3 (г) + Cl2(г);  = +92,59 кДж.
= +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции - разложения PCl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая ( > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема (из одной молекулы газа Образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации РС13 или Cl2.
> 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема (из одной молекулы газа Образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации РС13 или Cl2.
Контрольные вопросы
121. Окисление серы и ее диоксида протекает по уравнениям: a) S(k) + 02 =
= SO2 (к); б) 2SO2 (г) + O2 =2S03 (г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
122. Напишите выражение для константы равновесия гомогенной системы N2 + ЗН2 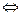 2NH3. Как изменится скорость прямой реакции - образования аммиака, если увеличить концентрацию водорода в три раза?
2NH3. Как изменится скорость прямой реакции - образования аммиака, если увеличить концентрацию водорода в три раза?
123. Реакция идет по уравнению N2 + 02 =2NO. Концентрации исходных веществ до начала реакции были:  = 0,049 моль/л;
= 0,049 моль/л;  = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда
= 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда  = 0,005 моль/л. Ответ:
= 0,005 моль/л. Ответ:  = 0,0465 моль/л;
= 0,0465 моль/л;  = 0,0075 моль/л.
= 0,0075 моль/л.
124. Реакция идет по уравнению N2 + ЗН2 = 2NH3. Концентрации участвующих в ней веществ были:  = 0,80 моль/л; |Н2] = 1,5 моль/л; |NH3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда
= 0,80 моль/л; |Н2] = 1,5 моль/л; |NH3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда  = 0,5 моль/л. Ответ:
= 0,5 моль/л. Ответ:  =
=
= 0,70 моль/л;  = 0,60 моль/л.
= 0,60 моль/л.
126. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ:  = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда
= 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда  = 0,03 моль/л. Ответ: 3,2 • 10 - 4; 1,92 • 10 - 4.
= 0,03 моль/л. Ответ: 3,2 • 10 - 4; 1,92 • 10 - 4.
126. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80°С. Температурный коэффициент скорости реакции 3.
127. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60°С, если температурный коэффициент скорости данной реакции 2.
128. В гомогенной системе СО + Сl2 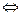 СОС12 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [С12] = 0,3 моль/л; [С0Cl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО. Ответ: К =20; [С12]ИСХ = 1,5 моль/л; [CO]ИСХ = 1,4 моль/л.
СОС12 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [С12] = 0,3 моль/л; [С0Cl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО. Ответ: К =20; [С12]ИСХ = 1,5 моль/л; [CO]ИСХ = 1,4 моль/л.
129. В гомогенной системе А + 2В 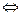 С равновесные концентрации реагирующих
С равновесные концентрации реагирующих
газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу
равновесия системы и исходные концентрации веществ А и В. Ответ: К =2,5; [A]ИСХ = 0,276 моль/л; [B]ИCX = 0,552моль/л.
130. В гомогенной газовой системе А + В 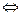 С + D равновесие установилось при
С + D равновесие установилось при
концентрациях: [B] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы
равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А]иcх =
= 0,22 моль/л; [В]исх= 0,07 моль/л.
131. Константа скорости реакции разложения N2О, протекающей по уравнению 2N2О = 2N2 + O2, равна 5 • 10 - 4. Начальная концентрация N2О = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N20. Ответ: 1,8-10 - 2; 4,6 * 10 - 3.
132. Напишите выражение для константы равновесия гетерогенной системы С02 + С = 2С0. Как изменится скорость прямой реакции - образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
133. Напишите выражение для константы равновесия гетерогенной системы С + Н20 (г) = С + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции - образования водяных паров?
134. Равновесие гомогенной системы 4HCI(г) + О2 = 2Н2О (г) + 2Сl (г)
установилось при следующих концентрациях реагирующих веществ: [H2O]P = 0,14 моль/л; [С12]р = 0,14 моль/л; [НС1]P = 0,20 моль/л; [O2]p = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [HCl] иcx = 0,48 моль/л; [02]ИСХ =0,39 моль/л.
135. Вычислите константу равновесия для гомогенной системы
СО (г) + Н20 (г) 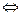 СО2 (г) + Н2 (г)
СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ: [СО]P = 0,004 моль/л; [Н20]P = 0,064 моль/л; [СO2]P = 0,016 моль/л; [Н2]P = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; [Н20]ИСХ = 0,08 моль/л; [СО]исх = 0,02 моль/л.
136. Константа равновесия гомогенной системы СО(г) + Н20(г) 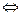 С02 + Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [CO]исх = 0,10 моль/л; [H2O]исх = 0,40 моль/л. Ответ: [CO2]p = [H2]p = 0.08 моль/л; [СО]р = 0,02 моль/л; [Н20]P = 0,32 моль/л.
С02 + Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [CO]исх = 0,10 моль/л; [H2O]исх = 0,40 моль/л. Ответ: [CO2]p = [H2]p = 0.08 моль/л; [СО]р = 0,02 моль/л; [Н20]P = 0,32 моль/л.
137. Константа равновесия гомогенной системы N2 + ЗН2 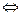 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]p = 8 моль/л; [N2]исх=8,04 моль/л.
2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]p = 8 моль/л; [N2]исх=8,04 моль/л.
138. При некоторой температура равновесие гомогенной системы 2NO + О2 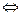 2NO2установилось при следующих концентрациях реагирующих веществ: [NO]p = 0,2 моль/л; [02]p = 0,1 моль/л; [NO2]p= 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию N0 и 02. Ответ: К-2,5; [NO]исх = 0,3 моль/л; [О2]исх= 0,15 моль/л.
2NO2установилось при следующих концентрациях реагирующих веществ: [NO]p = 0,2 моль/л; [02]p = 0,1 моль/л; [NO2]p= 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию N0 и 02. Ответ: К-2,5; [NO]исх = 0,3 моль/л; [О2]исх= 0,15 моль/л.
139. Почему при изменении давления смещается равновесие системы N2 + ЗН2 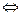 2NH3 и не смещается равновесие системы N2 + О2
2NH3 и не смещается равновесие системы N2 + О2 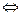 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
140. Исходные концентрации [NO]исх и [Cl2]исх в гомогенной системе 2NO + Cl2 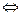 2NOCl составляет соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416.
2NOCl составляет соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416.
|
|
Дата добавления: 2014-10-23; Просмотров: 572; Нарушение авторских прав?; Мы поможем в написании вашей работы!