
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные конфигурации атомов
|
|
|
|
Схематическое изображение орбиталей с учетом их энергии называется энергетическая диаграммой атома. Она отражает взаимное расположение уровней и подуровней энергии.
На схеме орбитали обозначают в виде ячеек:  , а электроны - в виде стрелок:
, а электроны - в виде стрелок:  или
или 
Электрон может занять любую свободную орбиталь, но, согласно принципу минимума энергии, всегда предпочитает ту орбиталь, у которой энергия ниже. Принцип запрета Паули ограничивает число электронов на каждой орбитали. Поэтому в одной ячейке (на атомной орбитали) может быть только один или два электрона. На каждом s -подуровне (одна орбиталь) могут находиться два электрона, на каждом p -подуровне (три орбитали) - шесть электронов, на каждом d -подуровне (пять орбиталей) - десять электронов. Правило Гунда определяет порядок заселения орбиталей с одинаковой энергией.
Таким образом, можно получить последовательность заселения атомных орбиталей электронами:
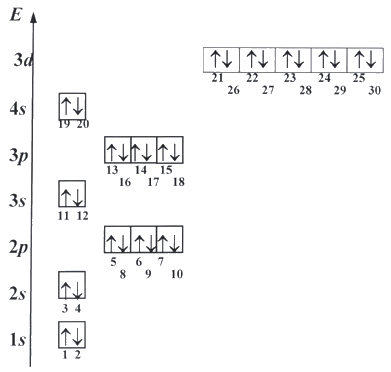 рисунок 11
рисунок 11
Действуя с помощью принципа минимума энергии, принципа Паули и правила Гунда, можно определить порядок заселения орбиталей электронами и построить электронную формулу любого элемента.
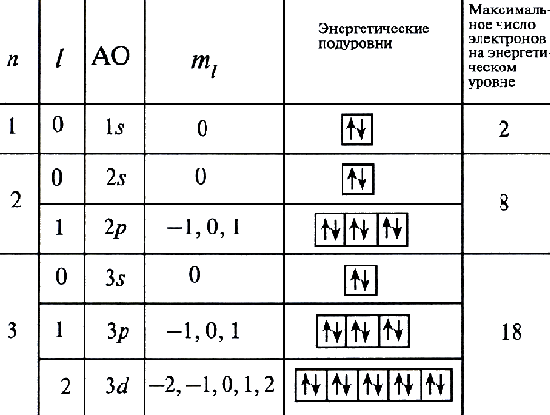
рисунок 12
Электронная конфигурация (формула) атома - распределение электронов по орбиталям в основном (невозбужденном) состоянии этого атома и его ионов: 1 s 22 s 22 p 63 s 23 p 6... Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы, например 3 d 5 - это 5 электронов на 3 d -подуровне.
Для краткости записи электронной конфигурации атома вместо орбиталей, полностью заселенных электронами, иногда записывают символ благородного газа, имеющего соответствующую электронную формулу:
1 s 2 = [He]
1 s 22 s 22 p 6 = [Ne]
|
|
|
1 s 22 s 22 p 63 s 23 p 6 = [Ar]
Например, электронная формула атома хлора 1 s 22 s 22 p 63 s 23 p 5, или [Ne]3 s 23 p 5. За скобки вынесены валентные электроны, принимающие участие в образовании химических связей.
Для больших периодов (особенно шестого и седьмого) построение электронных конфигураций атомов имеет более сложных характер. Например, 4 f -электрон появляется не в атоме лантана, а в атоме следующего за ним церия. Последовательное заполнение 4 f -подуровня прерывается в атоме гадолиния, где имеется 5 d -электрон.
От строения атома зависит его радиус, энергия ионизации, сродство к электрону, электроотрицательность и другие параметры атома. Электронные оболочки атомов определяют оптические, электрические, магнитные, а главное - химические свойства атомов и молекул, а также большинство свойств твердых тел.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1444; Нарушение авторских прав?; Мы поможем в написании вашей работы!