
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аномалии свойств, обусловленные наличием водородной связи
|
|
|
|
Наличием водородных связей обусловлены уникальные свойства многих веществ, в том числе воды. Трехатомная молекула Н2О образует четыре водородные связи. В их образовании принимают участие оба атома водорода, а атом кислорода, имеющий две неподеленные электронные пары, образует две водородные связи с атомами водорода соседних молекул воды.
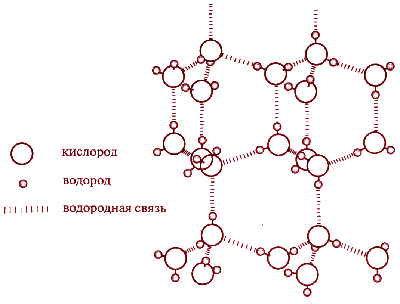
Если бы не было водородных связей, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов
Таблица 16 - Температуры кипения халькогеноводородов
| H2Te | H2Se | H2S | H2O | |
| t кип, oС | −2 | −42 | −60 |
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
Водородные связи являются причиной и другого уникального свойства воды - при плавлении ее плотность возрастает. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода - из других молекул воды. В результате образуется очень рыхлая "ажурная" структура. Вот почему лед такой легкий.
При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами.
Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение (1,00 г/мл) она имеет при температуре 4 oС. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью.
|
|
|
При замерзании вода расширяется и занимает больший объем. Плотность льда (0,92 г/мл) - меньше, чем плотность жидкой воды. Поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Наличие водородных связей влияет и на кислотные свойства многих веществ. Фтороводородная кислота, в отличие от других галогеноводородных кислот является слабой так как атомы водорода связаны сразу с двумя атомами фтора, что препятствует их отщеплению (по той же причине большинство карбоновых кислот являются слабыми). Благодаря особо прочным водородным связям фтороводородная кислота - единственная одноосновная кислота, способная образовывать кислые соли, например NaHF2.
4.6 Раздел: “Комплексные соединения”
Цель: изучить строение и свойства комплексных соединений.
Комплексных соединений значительно больше, чем всех других неорганических веществ, поэтому можно говорить о повсеместном распространении комплексов. Так почва содержит лимонную, малеиновую, винную, молочную кислоты, которые являются комплексообразующими реагентами, способствующими растворению оксида железа, карбоната кальция. Благодаря этому железо и кальций почвы становятся доступными для растений.
Комплексными называются сложные соединения, образованные с участием донорно-акцепторного механизма.
В эмпирических формулах комплексных соединений различают внутреннюю сферу (выделяемую квадратными скобками) и внешнюю сферу. Например, в комплексных соединениях К3 [Fe (CN)6]-3, [Ag(NH3)2]+ Cl-
внешняя внутренняя внутренняя внешняя
сфера сфера сфера сфера
Внутренняя сфера комплексных соединений состоит из центрального атома – комплексообразователя (в указанных примерах Fe+3, Ag+), вокруг которого координированы лиганды – ионы противоположного знака или молекулы (в данных примерах СN-, NH3).
|
|
|
Общее число связей комплексообразователя с донорными атомами лигандов называют координационным числом комплексообразователя (в приведенных примерах к.ч.= 6 и к.ч. =2, соответственно).
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов.
Например, в К3 [Fe+3 (CN)6]-3 заряд комплексного иона (–1)· 6 + (+3)·1 = -3
В основе классических представлений о строении молекул комплексных соединений лежит координационная теория, созданная А.Вернером.
Суть теории можно свести к следующим положениям:
1) центральное место в комплексном соединении занимает комплексообразователь, обычно, положительно заряженный ион (чаще всего металл);
2) вокруг комплексообразователя расположены (координированы) лиганды (старое название аденды), т.е. ионы противоположного знака или нейтральные молекулы;
3) комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения;
4) ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплексного соединения.
По общепринятым обозначениям внутренняя сфера отделяется от внешней квадратными скобками. Так комплексное соединение Fe(CN)3 ∙3KCN может быть изображено:
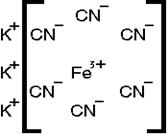
Число, показывающее, сколько лигандов удерживает комплексообразователь, называют координационным числом.
В приведённом примере оно равно 6.
Для написания формулы комплексного соединения надо знать:
1) заряд (степень окисления) комплексообразователя.
2) заряд лигандов.
3) координационное число.
4) ионы внешней сферы.
Типичными комплексообразователями является катионы d - элементов периодической системы А.И.Менделеева. Это 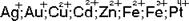 и др. Важнейшими лигандами являются:
и др. Важнейшими лигандами являются:
а) нейтральные молекулы:H2O,NH3,NO,CO и др.
б) анионы  и др.
и др.
Координационные числа чаще всего имеют значение 6 и 4, реже 2 и 8.
Некоторые комплексные соединения не имеют внешней сферы - у них отрицательный заряд ионов, входящих во внутреннюю сферу, равен положительному заряду комплексообразователя. Это [Pt(NH3)Cl4], [Co(NH3)Cl3] и многие другие.
Чтобы написать формулу комплексного иона,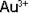 (коорд. число 2) и лиганда
(коорд. число 2) и лиганда
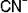 , надо написать Au, рядом лиганд (дважды) и затем определить заряд комплексного иона.
, надо написать Au, рядом лиганд (дважды) и затем определить заряд комплексного иона.
|
|
|
В примере заряд иона [Au(CN)2] равен (+3) + (-2)= +1.
Формула комплексного иона [Au(CN)2]+
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов.
Комплексные соединения в растворе диссоциируют по типу сильного электролита на комплекс и внешнюю сферу:
К3 [Fe (CN)6]-3 → 3К++ [Fe (CN)6]-3
Внутренняя сфера же является слабым электролитом и диссоциирует обратимо и ступенчато:
1) [Fe (CN)6]-3 ↔ [Fe (CN)6]-2 + СN-
2) [Fe (CN)6]-2 ↔ [Fe (CN)4]-1 + СN- …3)…; 4)…; 5 …;
6) [Fe (CN)]+2 ↔ Fe +3+ СN-
Общая константа диссоциации по ступеням комплексного иона называется константой нестойкости (К). Чем меньше константа нестойкости, тем прочнее комплекс.

|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1155; Нарушение авторских прав?; Мы поможем в написании вашей работы!