
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы для самостоятельной подготовки к лабораторной работе
Лабораторная работа №2.
Цель: научиться делать расчеты и готовить растворы различной концентрации из сухой соли или более концентрированного раствора.
1. Что называется раствором?
2. Чем отличается раствор от механических смесей?
3. Какой раствор называют насыщенным, пересыщенным, разбавленным и концентрированным?
4. Может ли быть насыщенный раствор разбавленным, а концентрированный раствор ненасыщенным?
5. Как выражают содержание растворенного вещества в растворе?
6. Дайте определение молярной, процентной концентраций и молярной концентрации эквивалента вешества.
7. Как найти молярные массы эквивалентов кислоты, гидроксида, соли в реакциях обмена?
Опыт 1. Приготовление раствора с заданной массовой долей соли (%).
Приборы и реактивы: колба на 100мл; мерный цилиндр на 250мл; ареометр; сульфат аммония.
Ход опыта.
1. Получите у преподавателя задание и рассчитайте необходимое для приготовления раствора заданной концентрации количества соли и воды.
2. Рассчитанное количество соли взвесьте на технологических весах и поместите в колбу на 100мл.
3. Отмерьте цилиндром необходимое количество воды и влейте в колбу с солью. Раствор перемешайте.
4. Приготовленный раствор перелейте из колбы в чистый цилиндр и измерьте ареометром его плотность. Сравните ее значение с табличной величиной плотности, соответствующей данной концентрации (приложение 6).
5. Рассчитайте молярную, нормальную концентрации и титр приготовленного раствора. Результаты опыта сведите в таблицу:
| Масса | Плотность раствора | Концентрация раствора | Титр | |||
| Соли | Воды | Процентная | Нормальная | Молярная | ||
Опыт 2. Приготовление раствора с заданной массовой долей (%) соли из более концентрированного раствора.
Приборы и реактивы: мерный цилиндр на 250мл; склянки с готовыми растворами сульфата аммония.
Ход опыта.
1. Получите у преподавателя задание: № исходного раствора и значение концентрации нового раствора.
2. В мерный цилиндр (на 250 мл.) налейте 200 мл исходного готового раствора соли и ареометром определите его плотность.
3. По измеренной плотности найдите % концентрацию раствора (приложение 6).
4. Рассчитайте объем исходного раствора соли, необходимый для приготовления раствора заданной концентрации.
Чтобы вычислить соотношения в каких необходимо взять два исходных раствора известной концентрации для получения раствора заданной концентрации используют «правило креста» или «квадрат Пирсона». Пользуясь этим способом, значения исходных концентраций растворов располагают слева друг над другом: сверху – большую (а), а снизу – меньшую (в). В центре между ними, по косой, пишут концентрацию, которую требуется получить (с). Вычитая по диагонали, слева направо, из большей величины концентрации меньшую, получаем искомые массы исходных растворов. В общем виде схема расчетов по правилу «креста» имеет следующий вид:
а (с - в) г раствора а% - го
с
в (а- с) г раствора в% - го
Если смешать рассчитанные количества а% раствора с в% раствором того же вещества, получается с% раствор.
Например, исходный раствор хлорида натрия имеет концентрацию 20% и его плотность 1,148. И из него необходимо приготовить раствор концентрацией 12%. Тогда нужно взять 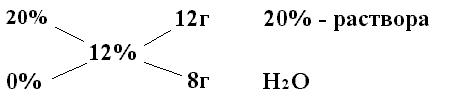 При смешивании 12г 20% раствора и 8г воды получаем 20г 12% раствора.
При смешивании 12г 20% раствора и 8г воды получаем 20г 12% раствора.
Нам же необходимо приготовить 250г 12% раствора.
Тогда, для приготовления
20г 12% раствора необходимо - 12г исходного раствора
250г 12% раствора – Хг исходного раствора

Следовательно, нужно отвесить 150г исходного раствора, добавить к нему 250г – 150г = 100г воды, смешать и получиться раствор заданной 12% концентрации.
Но жидкость гораздо удобнее брать в объемных количествах, а не в весовых. Используя значения плотностей, рассчитаем необходимые объемы исходного раствора и воды по формуле:  ; где
; где
V – объем (мл), m – масса (г), p – плотность (г/мл)
Тогда  20% раствора;
20% раствора;  воды.
воды.
Общий объем 12% раствора составит 132мл + 100мл = 232мл.
5. Отмерьте цилиндром рассчитанный объем исходного раствора и долейте водой до рассчитанного общего объема 12% раствора.
6. Приготовленный раствор перелейте и измерьте ареометром плотность.
7. С помощью приложения 6 найдите соответствующую % - ную концентрацию. Ошибка должна составить + или - 2% от задания.
8. Рассчитайте молярную и нормальную концентрацию эквивалентов и титр приготовленного раствора.
Результаты опыта оформите в виде таблицы1.
Таблица 1.
| Плотность раствора | Массовая доля % | V мл | p г/мл | Концентрация | Титр | |||
| исходного | заданного | исходного | заданного | молярная | молярнаяэквивалента | |||
|
|
Дата добавления: 2014-10-23; Просмотров: 464; Нарушение авторских прав?; Мы поможем в написании вашей работы!