
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катионы I аналитической группы
|
|
|
|
Реакции катиона Na+:
1. Реактив KH2SbO4 – дигидроантимонат калия К 2-3 каплям раствора соли натрия прибавляют 2-3 капли реактива. На холоде, при потирании стеклянной палочкой образуется белый мелкокристаллический осадок. NaCl + KH2SbO4 ® NaH2SbO4 ¯ + KCl
(бел. кр.)
Реакция исследуемого раствора должна быть нейтральной, так как в кислой среде идет разложение реактива с образованием белого аморфного осадка м-сурьмяной кислоты HSbO3.
KH2SbO4 + HCl ® H3SbO4 + KCl
H3SbO4 ® HSbO3¯ + H2O
(бел. аморфн.)
В щелочной среде осадок растворяется: NaH2SbO4 ¯ + NaOH® Na3SbO4 + 2 H2O
Обнаружению Na+ мешают соли аммония: NH4+ + HOH Û NH4OH + H+ pH< 7
H+ + H2SbO4- ® HSbO3¯ + H2O
2. Крупинка соли Na+, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Реакции катиона К+:
1. Реактив NaHC4H4O6 К 2-3 капли раствора соли калия прибавляют 2-3 капли реактива. На холоде, при потирании стеклянной палочкой образуется белый мелкокристаллический осадок. KCl + NaHC4H4O6 ® KHC4H4O6¯ + NaCl
(белый)
При нагревании, добавлении сильных минеральных кислот и щелочей осадок растворяется:
KHC4H4O6¯ + HCl ® KCl + H2C4H4O6
KHC4H4O6¯ + KOH ® K2C4H4O6 + H2O
KHC4H4O6¯ + NaOH ® KNaC4H4O6 + H2O
Если вместо NaHC4H4O6 используют свободную кислоту H2C4H4O6, то для предотвращения растворения осадка реакцию ведут в присутствии ацетата натрия CH3COONa:
KCl + H2C4H4O6 CH3COONa KHC4H4O6¯ + HCl
 HCl + CH3COONa ® NaCl + CH3COOH
HCl + CH3COONa ® NaCl + CH3COOH
KCl + H2C4H4O6 + CH3COONa ® KHC4H4O6¯ + NaCl + CH3COOH
2. Реактив кобальти нитрит натрия или гексанитрокобальтат (III) натрия Na3[Co(NO2)6] К 2-3 каплям раствора соли калия прибавляют равный объем реактива. При стоянии образуется осадок желтого цвета. KCl + Na3[Co(NO2)6] ® KNa2[Co(NO2)6]¯ + NaCl
В щелочной среде реактив разлагается
Na3[Co(NO2)6] + 3NaOH ® Co(OH)3¯ + 6NaNO2
(бурый)
3. Крупинка соли К+, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет.
|
|
|
Реакции катиона NH4+:
1. Едкие щелочи NaOH или KOH. При действии на 2-3 капли раствора соли аммония раствором щелочи при нагревании выделяется газообразный аммиак. NH4Cl + KOH ® NH3 + H2O + KCl
Выделяющийся аммиак определяют по запаху или по: - посинению влажной красной лакмусовой бумаги; - покраснению белой фенолфталеиновой бумаги;
NH3 + H2O Û NH4+ + OH- pH >7
2. Реактив Несслера - K2[HgI4] в KOH К 1 капле раствора соли аммония прибавляют 1 каплю раствора реактива Несслера. Образуется осадок красно-бурого цвета.
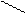
 Hg
Hg
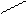
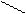 NH4Cl + 2K2[HgI4] + 4KOH ® [O NH2]I¯ + KCl + 7KI + 3H2O
NH4Cl + 2K2[HgI4] + 4KOH ® [O NH2]I¯ + KCl + 7KI + 3H2O
Hg
(кр.-бур.)
При очень малых количествах солей аммония появляется желтое окрашивание.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 3116; Нарушение авторских прав?; Мы поможем в написании вашей работы!