
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 2. Лужні метали
Основні теоретичні відомості
До головної підгрупи І групи елементів періодичної системи належать лужні метали: Літій Li, Натрій Na, Калій К, Рубідій Rb, Цезій Cs, Францій Fr. У зовнішньому електронному шарі атомів лужних металів розміщується по одному електрону, у передостанньому електронному шарі атома Літію міститься два електрони, а у решти атомів лужних металів по вісім електронів. Тому атоми цих елементів легко віддають один електрон, тобто мають низьку енергію йонізації, яка зменшується в підгрупі зверху вниз. Послаблення зв'язку електрона з ядром (зниження енергії йонізації) зумовлено зростанням радіусів атомів і екрануванням позитивно зарядженого ядра електронами внутрішніх шарів. Тому лужні метали легко утворюють катіони Ме+. по схемі: Ме – 1 е- = Ме+. Всі лужні метали проявляють ступінь окиснення +1 та валентність 1. Радіуси атомів збільшуються зі збільшенням порядкового номеру елемента, і в цьому ж напрямку збільшуються їх відновна активність. Всі лужні метали дуже сильні відновники.
Зі збільшенням протонних чисел елементів радіуси їхніх атомів зростають, енергії йонізації зменшуються, а металічні властивості посилюються. Отже, найактивнішим з лужних металів є Францій.
Зберігаються лужні метали під шаром керосину, так як на повітрі вони досить швидко окислюються за рівнянням:
4Ме + О2 = 2 Ме2О
Лужні метали дуже м'які, легкоплавкі. Для літію, натрію, калію і рубідію характерний сріблясто-білий блиск, для цезію — золотистий. На повітрі лужні метали легко тьмяніють (Rb і Cs здатні самозайматися), реакція прискорюється під дією вологи. Лужні метали мають високі електро- і теплопровідність.
Робота з лужними металами потребує обережності, оскільки вони легко займаються, бурхливо реагують з водою та іншими речовинами.
Завдяки дуже високій активності лужні метали здатні реагувати з сухим воднем під час нагрівання з утворенням гідридів Ме, з азотом під час нагрівання з утворенням нітридів Ме3N.
Рубідій і цезій у кисні здатні самозайматися, натрій і літій займаються лише під час нагрівання. Тільки літій утворює оксид Li2O, а всі інші лужні метали — пероксиди або надпероксиди. Так, натрій внаслідок взаємодії з киснем утворює пероксид Na2O2, а К, Rb, Cs — надпероксиди МеО2.
Пероксиди і надпероксиди лужних металів — сильні окисники.
Оксиди натрію, калію, рубідію і цезію можна добути окисненням у разі нестачі кисню або під час взаємодії стехіометричних кількостей металу і пероксиду. Оксиди Li2O і Na2O — безбарвні, К2О і Rb2O — мають жовте забарвлення, Cs2O — оранжеве.
Пероксиди можна розглядати як солі пероксиду гідрогену Н2О2. Під час розчинення у воді пероксиди повністю гідролізують, оскільки кислотні властивості Н2О2 виражені дуже слабко:
Na2O2 + 2Н2О = 2NaOH + Н2О2.
Оксиди лужних металів дуже енергійно взаємодіють з водою з утворенням лугів:
К2О + Н2О = 2КОН.
Ще енергійніше з водою реагують самі лужні метали, причому зі збільшенням протонного числа елемента інтенсивність взаємодії його з водою зростає (Rb і Cs реагують з водою з вибухом):
2К + 2Н2О = 2КОН + Н2↑
Гідроксиди лужних металів, особливо літію, натрію і калію, дуже важливі сполуки.
Водні розчини гідрооксидів є сильними основами і виявляють сильно лужну реакцію внаслідок дисоціації їх на йони за загальною схемою:
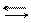 МеОН Ме+ + ОН-
МеОН Ме+ + ОН-
Гідроксиди лужних металів розчиняються у воді з виділенням великої кількості теплоти, що свідчить про утворення гідратів. Розчини МеОН у воді дуже агресивні відносно різних речовин, тому їх називають їдкими лугами.
Лужні метали енергійно взаємодіють з кислотами, наприклад:
2Li + 2HCl = 2LiCl + H2 ↑
Важливими солями лужних металів є нітрати, галогеніди, сульфати, карбонати. Всі вони розчинні у воді. Кристалізуючись, утворюють кристалогідрати, отже, вони гігроскопічні. Солі літію найбільш гігроскопічні, а солі цезію — найменш гігроскопічні.
Із солей лужних металів найбільше практичне значення мають: карбонат натрію, або кальцинована сода, Na2CO3, гідрогенкарбонат натрію, або питна сода, NaHCO3 та кристалогідрат Na2CO3·10Н2О, нітрати натрію NaNО3 та калію К NО3 (добрива), хлорид натрію NаCl (поварена сіль).
Якщо внести в полум'я пальника сіль лужного металу, воно набуде забарвлення, характерного для даного металу: літій забарвлює полум'я в кармінно-червоний колір, натрій — у жовтий, калій — у фіолетовий. За забарвленням полум'я можна виявляти ці елементи.
Лабораторна робота
Дослід 1. Взаємодія лужних металів з повітрям та водою.
(Роботу проводити за склом витяжної шафи).
а). Винути пінцетом із банки з керосином шматочок металічного літію, покласти його на фільтровальний папір і відрізати від нього ножем шматочок величиною з горошину. Звернути увагу на потускніння блискучої металічної поверхні свіжого надрізу. Добре просушити метал фільтровальним папіром і помістити у фарфорову чашку наповнену водою. Прикрити чашку склом. Спостерігайте за ходом реакції. Який газ виділяється?
б). Аналогічні досліди провести з металічним натрієм та калієм. Визначити, який з металів найбільш активно взаємодіє з водою. Чи узгоджується ций висновок з його положенням в ряді стандартних електродних потенціалів. Який газ при цьому виділяється? Дослідити реакцію розчинів фенолфталеіном. Написати рівняння відповідних реакцій.
Дослід 2. Взаємодія натрій пероксиду з волою.
В суху пробірку внести 1 мікрошпатель натрій пероксиду і додати 4-5 крапель води. Розчин підігріти і внести у пробірку тліючу скіпку. Який газ при цьому виділяється? Після закінчення реакції до розчину додати 1-2 краплі фенолфталеїну. У який колір забарвлюється розчин в пробірці? Скласти рівняння реакцій натрій пероксиду з водою.
Дослід 3 Гідроліз солей лужних металів.
У три пробірки помістити окремо декілька кристалів калій хлориду, натрій карбонату, натрій фосфату. Прилити по 2-3 мл дистильованої води і додати 1 краплю лакмусу. Які солі повинні підлягати гідролізу і чому? Написати рівняння відповідних реакцій гідролізу в молекулярній та йонній формах.
Дослід 4. Якісні реакції на катіони натрію  та калію
та калію  .
.
а). У пробірку з 2-3 краплями розчину натрій хлориду додати таку саму кількість розчину гексагідроксостибіатат (V) калію 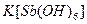 . Реакцію проводити при охолодженні розчину водою з під крана і потиранні внутрішніх стінок паличкою. Спостерігати утворення білого дрібнокристалічного осаду. Скласти рівняння реакцій в молекулярній та йонній формах.
. Реакцію проводити при охолодженні розчину водою з під крана і потиранні внутрішніх стінок паличкою. Спостерігати утворення білого дрібнокристалічного осаду. Скласти рівняння реакцій в молекулярній та йонній формах.
б). До 3-4 крапель розчину калій хлориду додати 3 краплі розчину комплексної солі гексанітрокобальтат (III) натрію 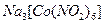 і спостерігати за утворенням жовтого кристалічного осаду гексанітрокобальтат (III) калію-натрію
і спостерігати за утворенням жовтого кристалічного осаду гексанітрокобальтат (III) калію-натрію 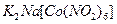 .
.
Скласти рівняння в молекулярній та йонній формах.
Дослід 5. Забарвлення полум’я солями лужних металів.
Очищену шляхом промивання в хлоридній кислоті і прожарювання ніхромову проволоку внести у розчин солі Літію, а потім в полум’я пальника. Спостерігати забарвлення полум’я. Теж саме виконати з солями Натрію та Калію.
Ніхромову проволоку після кожної солі промити у хлоридній кислоті і прожарити до повного зникнення забарвлення полум’я.
|
|
Дата добавления: 2014-10-31; Просмотров: 1243; Нарушение авторских прав?; Мы поможем в написании вашей работы!