
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 13. Купрум. Аргентум
Контрольні запитання та задачі
1. Написати електронні формули атомів Феруму, Кобальту та Ніколю, показати їх можливі валентні стани та ступені окиснення.
2. Указати, як змінюються відновні властивості сполук у ряді:
Fe(ІІ) → Сo(ІІ) → Ni(ІІ).
3. Порівняти кислотно-основні властивості гідроксидів Феруму у ряду Fe(OH)2 → Fe(OH)3.
4. Скласти рівняння реакції одержання калій ферату при взаємодії ферум(Ш) хлориду з бромом у лужному середовищі. Підберіть коефіцієнти методом електронного балансу.
5. Написати рівняння окисно-відновних реакції та підібрати коефіцієнти методои електронного балансу:
a) Fe(OH)2 + O2 + H2O→
b) Co(OH)3 + H2SO4→
c) Ni(OH)2 + Br2 + NaOH→
d) K2FeO4 + H2O→
e) FeCl3 + SnCl2→
6. Скласти рівняння реакцій за допомогою котрих можливо здійснити наступні перетворення:
а) Сo2O3 → Co → Co(NO3)2 → Co(OH)2 → Co(OH)3 → CoCl2 → CoCl3
б) NiO →Ni → Ni(NO3)2 → Ni(OH)2 → Ni(OH)3 → NiCl2.
7. Як змінюється стійкість сполук Fe(III), Co(III), Ni(III) у ряду Fe – Co – Ni? Якого типу сполуки найбільш характерні для Со(ІІІ)?
Основні теоретичні відомості
До побічної підгрупи І групи належать елементи Купрум Сu, Аргентум Ag і Аурум Аu. Кожен з них у своєму періоді є передостаннім d-елементом. Отже, в зовнішньому електронному шарі атомів елементів підгрупи купруму в (n- 1)d-стані повинно знаходитись по дев'ять електронів. Оскільки цей підрівень близький до завершення, енергетично вигіднішим є перехід одного з s-електронів із зовнішнього шару в (n - 1)d-стан. Тому атоми Cu, Ag, Аu в зовнішньому електронному шарі містять по одному електрону, а в передостанньому — по 18 електронів (s2p6d10).
У разі збудження атомів Сu, Ag, Аu в утворенні хімічного зв'язку можуть брати участь один або два d-електрони передостаннього електронного шару, оскільки завершення d-підрівня атомів цих елементів відбувається внаслідок переходу зовнішнього s-електрона, і повна стабілізація 18-електронної структури ще не досягається. Відповідно до цього елементи підгрупи купруму виявляють ступені окиснення не тільки +1, а й +2 і +3. Для Купруму найхарактернішим є ступінь окиснення +2, для Арґентуму +1, для Ауруму +3 і навіть +5. Сполуки Купруму зі ступенем окиснення +3 дуже нестійкі. Особлива стійкість ступеня окиснення атома Аргентуму +1 пояснюється відносно більшою міцністю конфігурації 4d10, оскільки ця конфігурація утворюється ще у попередника Аргентуму — Паладію.
Усі елементи ІВ групи належать до мало поширених у земній корі. Вони існують як у вільному стані, так і у вигляді сполук. Купрум Найчастіше знаходиться у природі у формі сульфідів (Сu2S – мідний блиск, СuFеS2 – мідний колчедан) та кисневмісних сполук (Сu2О – куприт, (СuОН)2СО3 - малахіт). Крім аргентиту Аg2S. Аргентуму міститься в поліметалічних рудах. Аурум також є у домішках поліметалічних руд, але в основному у природі воно знаходиться в самородному стані. З кисневмісних руд Купрум безпосередньо відновлюють вугіллям (коксом). Пірометалургічний метод добування міді із сульфідних руд ґрунтується на окисленні Сu2S до СuО:
Сu2S + 2О2 = 2СuО + SО2
який далі відновлюється до Сu2О і реагує з надлишком сульфіду міді:
2Сu2О + Сu2S = 6Сu + SО2.
Срібло одержують при переробці поліметалургічних (Аg, Рb, Zn) сульфідних руд. Після їх випалювання срібло міститься у розплаві цинку. У розплаві срібло та цинк знаходяться над свинцем. Із суміші срібла та цинку останній відганяють (tкип Zn = +906°С), а свинець видаляють у вигляді оксиду. Одержане срібло очищають електролізом.
Із золотовмісних руд золото переважно одержують хімічним способом. Для цього золото від пустої породи відділяють промиванням водою, а потім його розчиняють у ртуті або у розчині ціаніду калію в присутності кисню. Внаслідок цього утворюється комплексна сіль диціаноаурат (І) калію:
4Аu + О2 + 8КСN + 2Н2О = 4К[Аu(СN)2] + 4КОН.
З одержаного розчину золото відновлюють цинком:
2К[Аu(СN)2] + Zn = К2[Zn(СN)4] + 2Аu.
Мідь, срібло та золото – м’які блискучі метали.Мідь має червоний колір, срібло – сріблясто-білий, золото – жовтий. Усі ці метали дуже пластичні. Золоті пластинки можна прокатати до товщини 10-4 мм. Срібло має найвищу серед металів теплопровідність та електропровідність. На цьому засновано його використання у приладобудуванні. Хімічна активність елементів підгрупи купруму Сu - Аg – Аu швидко зменшується.
З киснем реагує лише мідь. При нагріванні міді до 400 – 500 °С у присутності кисню утворюється СuО:
2Сu + О2 = 2СuО.
На повітрі при наявності СО2 та вологи мідь окислюється з утворенням купрум гідроксидкарбонату:
2Сu + О2 + СО2 + Н2О = Сu2(ОН)2СО3.
При нагріванні вище 1100 °С СuО розкладається на Сu2О та О2. Благородні метали Аg та Аu не окислюються киснем навіть при нагріванні. Елементи підгрупи Купруму малоактивні метали.
Хача мідь малоактивна, але у вологому повітрі вона поступово вкривається зеленою плівкою гідроксокарбонату купруму (ІІ) Сu2(ОН)2СО3. При нагріванні Сu та Аg реагують з сіркою, утворюючи Сu2S та Аg2S. При нагріванні з хлором утворюються вищі хлориди СuСl2, АgСl2, АuСl3.
В електрохімічному ряді напруг Сu, Аg та Аu розміщені за воднем, тому не витясняють водень з розчинів кислот не окисників. Мідь та срібло легко розчиняються в нітратній кислоті:
3Сu + 8HNO3 (розб.) = 3Cu(NO3)2 + 2NO↑ + 4Н2О.
Аg + 2HNO3 (к.) = АgNO3 + NO2↑ + Н2О.
Продуктом відновлення концентрованої Н2SО4 при реакції з міддю та сріблом є SО2, наприклад:
3Сu + 2Н2SО4 = CuSO4 + SО2↑ + 2Н2О.
Золото в HNO3 не розчиняється, але взаємодіє з «царською водкою»:
Аu + HNO3 + 4НСl = Н[АgСl4] + NO↑ + 2Н2О.
Золото легко розчиняється у гарячій концентрованій Н2SеО4:
2Аu + 6Н2SеО4 = Аu2(SO4)3 + 3SеО2 + 6Н2О.
Срібло має велику спорідненість до сірки та, незважаючи на те, що у ряді напруг воно розміщене за воднем, у присутності кисню повітря реагує з сірководнем з утворенням Аg2S Аргентуму сульфіду (вироби із срібла на повітрі, в якому є незначні домішки сірководню, темніють):
4Аg + 2Н2S + О2 = 2Аg2S + 2Н2О.
З воднем мідь безпосередньо не взаємодіє. З киснем мідь утворює два оксиди — чорний CuO і червоний Сu2О. Оксид купруму (ІІ) CuO утворюється під час нагрівання міді до 400—500 °С за наявності кисню. CuO внаслідок нагрівання до температури понад 1100 °С розкладається на Сu2О і О2. Оксид купруму (ІІ) зручно добувати термічним розкладанням основного карбонату купруму (малахіту):
(СuОН)2СО3 = 2СuО + Н2О↑ + СО2↑.
Оксид купруму (І) Сu2О можна добути, добавляючи до розчину CuSO4 луг і відновник (глюкозу, гідразин, гідроксил амін) під час нагрівання.
Оксид купруму (І) і купруму (ІІ) з водою не взаємодіють, розчиняються у кислотах з утворенням солей купруму (І) і купруму (ІІ).
Сu2О + 2НСl = 2СuСl + Н2О,
СuО + Н2SО4 = СuSО4 + Н2О.
Оскільки для купруму дуже стійкими є амінокомплекси, то Сu2О і CuO легко розчиняються у водному розчині аміаку:
Сu2О + 4NH3 + Н2О = 2[Cu(NH3)2]OH;
CuO + 4NH3 + H2O = [Cu(NH3)4](OH)2.
Під час сплавляння CuO з лугами утворюються темно-сині купрати Ме2СuО2.
Під дією лугів на розчини солей Купруму (ІІ) осаджується синій гідроксид Сu(ОН)2:
СuSО4 + 2NаОН = Сu(ОН)2 + Nа2SО4.
Це слабка основа, що виявляє також слабкі амфотерні властивості, вона розчиняється в концентрованих розчинах лугів з утворенням яскраво-синіх розчинів тетрагідроксокупратів Ме2[Сu(ОН)4] та аміаку з утворенням сильної комплексної основи [Cu(NH3)4](OH)2 — гідроксиду тетрамінкупруму (ІІ):
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4];
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2,
а також у розчинах кислот:
Cu(OH)2 + 2HСl + 2Н2О = [Cu(H2O)4]Сl2;
Під час нагрівання Сu(ОН)2 легко розкладається:
Cu(OH)2 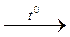 CuO + Н2О.
CuO + Н2О.
Всі солі Купруму (ІІ), як солі слабкої основи, здатні сильно гідролізу вати. Розчини солей Купруму (ІІ) здебільшого мають кислу реакцію:
CuСl2 + Н2О = CuOHСl + НСl.
Дією на розчини, які містять солі Купруму (І) карбонатів лужних металів утворюється зеленувато-блакитний осад основного карбонату купруму:
2СuSО4 + 2Nа2СО3 + Н2О = (СuОН)2СО3↓ + 2Nа2SО4 +СО2.
Солі Купруму (ІІ) мають окисні властивості. Так, при додаванні до розчину СuSО4 калій йодиду виділяється йод та білий осад купруму (І) йодиду:
2Сu+2SО4 + 4КІ-1 = 2Сu+1І↓ +І2° + 2К2SО4.
Окиснення СuІ на повітрі не відбувається внаслідок малої величини його добутку розчинності.
Для одержання білого малорозчинного у воді хлориду купруму (І) СuСl нагрівають суміш СuСl2, концентрованої НСl та порошкоподібної міді (для створення відновного середовища):
Сu + СuСl2 + 2НСl = 2Н[СuСl2].
При розведення водою комплекс руйнується і СuСl випадає в осад:
2Н[СuСl2] = НСl + СuСl.
Хлорид купруму (І) малостійкий, проявляє відновні властивості, тому легко окислюється Оксисеном повітря до СuСl2:
4СuСl2 + О2 + 4НСl = 4СuСl2 + 2Н2О.
Для похідних купруму (І) характерні реакції диспропорціонування:
2СuСl → Сu + Сl2.
Для одержання більшості сполук Аргентуму використовують аргентум нітрат АgNО3, який добувають розчиненням срібла в нітратній кислоті.
Срібло утворює один ряд солей, розчини яких містять безбарвні йони Ag+. Сполуки аргентуму (ІІ) дуже нестійкі. Під дією лугів на розчини солей аргентуму випадає бурий осад оксиду аргентуму Ag2O:
2AgNO3 + 2NaOH = Ag2O↓ + 2NaNO3 + H2O.
Випадання осаду Ag2O зумовлено тим, що гідроксид аргентуму AgOH може існувати тільки в дуже розбавлених розчинах, під час виділення він розкладається на Ag2O і Н2О. Оксид аргентуму Ag2O дещо розчинний у воді (0,01 г/л за температури 20 °С), розчин має лужну реакцію. Очевидно, в розчині є молекули гідроксиду аргентуму AgOH, що є сильною основою. Це підтверджується тим, що солі арґентуму (І) не гідролізують.
Для арґентуму (І) характерне комплексоутворення, особливо міцними є амінокомплекси, тому Ag2O добре розчиняється в розчинах аміаку з утворенням сильної комплексної основи:
Ag2O + 4NH3 + Н2О = 2[Ag(NH3)2]OH.
Сполука [Ag(NH3)2]OH значно стійкіша, ніж AgOH, і за силою наближається до лугів. Це пояснюється зменшенням поляризаційної дії йона Ag+ на йони ОН- за рахунок екранування їх молекулами аміаку.
Крім оксиду арґентуму (І) Ag2O відомі оксиди AgO і Ag2O3. Оксид Ag2O — бурого кольору, AgO і Ag2O3 — чорного, добути їх можна тільки непрямим способом. Всі ці оксиди належать до солетворних. Кислотно-основна природа їх визначається загальним правилом: від Ag2O до Ag2O3 посилюється кислотна функція, в той час як Ag2O основний, AgO і Ag2O3 — амфотерні.
Під час нагрівання срібла з галогенами утворюються галогеніди. Галогеніди аргентуму, за винятком AgF, у воді не розчиняються. Галогеніди аргентуму, подібно до NaCl, мають кубічні кристалічні ґратки. Хлорид аргентуму забарвлений у білий колір, AgBr — у блідо-жовтий, AgІ і AgF — у жовтий. У разі безпосереднього сполучення срібла з фтором утворюється тверда сполука AgF2 коричнево-чорного кольору.
Хлорид аргентуму утворюється у вигляді білого сирнистого осаду внаслідок взаємодії йонів аргентуму з хлорид-іонами. AgCl не розчиняється у воді і кислотах, але добре розчиняється в аміаку з утворенням розчинного, досить стійкого комплексного йона [Ag(NH3)2]+:
AgCl + 2NH3 = [Ag(NH3)2]+ + Сl-.
Під дією кислот аміакат аргентуму руйнується з утворенням стійкішого, порівняно з [Ag(NH3)2]+, комплексного йона NH4+:
[Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3.
AgCl під час нагрівання помітно розчиняється в концентрованому розчині хлоридної кислоти і в концентрованих розчинах хлоридів лужних металів, ціаніду калію, тіосульфату натрію. Розчинність AgCl зумовлена утворенням комплексних йонів: [AgCl3]2-, [Ag(CN)2]-, [Ag(S2O3)2]3-.
Бромід аргентуму AgBr не розчиняється у воді й нітратній кислоті, погано розчиняється в аміаку і добре у ціаніді калію і тіосульфаті натрію з утворенням аналогічних комплексів.
AgBr + 2Nа2S2О3 = Nа3[AgS2О3] + NаВr.
В підгрупі Купруму золото є найпасивнішим металом. У сполуках Аурум може виявляти ступені окиснення +1, +2, +3. Найменш характерний для нього ступінь окиснення +2, найбільш характерний +3.
Відомі оксиди ауруму: сіро-фіолетовий Аu2О, темно-зелений АuО і темно-коричневий Аu2О3. Добути їх можна тільки непрямими способами.
Основними вихідними речовинами для одержання інших сполук Ауруму є АuСl3 та Н[АuСl4]. АuСl3 одержують нагріванням порошку Аu з надлишком Сl2:
2Аu + 3Сl2 = 2АuСl3.
Тетрахлороаурат (ІІІ) гідрогену Н[АuСl4] утворюється внаслідок розчинення золота в «царській водці» або взаємодією АuСl3 з хлоридною кислотою:
АuСl3 + НСl = Н[АuСl4].
При дії лугів на розчини АuСl3 та Н[АuСl4] утворюється бурий осад гідроксиду ауруму (ІІІ):
АuСl3 + 3КОН = Аu(ОН)3 +3КСl,
Н[АuСl4] + 4NаОН = Аu(ОН)3 + 4NаСl + Н2О.
Аu(ОН)3 – амфотерний гідроксид, розчинний у кислотах і лугах з утворенням відповідних аніонних комплексів:
Аu(ОН)3 + NаОН = Nа[Аu(ОН)4],
Аu(ОН)3 + 4НNО3 = Н[Аu(NО3)4] + 3Н2О.
При обережному нагріванні Аu(ОН)3 до 140 – 150 °С утворюється оксид Аu2О3:
2Аu(ОН)3 = Аu2О3 + 3Н2О.
Якщо нагрівати оксид Аu2О3, то він у свою чергу розкладається:
2Аu2О3 = 4Аu + 3О2.
Оксид ауруму (ІІІ), як і відповідний йому гідроксид, має амфотерні властивості:
Аu2О3 + 2NаОН + 3Н2О = 2Nа[Аu(ОН)4].
Аu2О3 = 8НСl(к) = 2Н[АuСl4] + 3Н2О.
Для Ауруму мало характерні сполуки зі ступенем окиснення +1. При нагріванні АuСl3 до 185 °С утворюється ауруму (І) АuСl:
АuСl3 = АuСl + Сl2
Сполуки ауруму (І) – нестійкі. Процес комплексоутворення призводить до їх стабілізації:
АuСl + 2КСN = К[Аu(СN)2] + КСl.
Сполуки ауруму (ІІІ) – окисники. При взаємодії Аu3+ та І- у водному розчині утворюється АuІ:
АuСl3 + 3КІ = АuІ + І2 + 3КСl.
Лабораторна робота
Дослід 1. Взаємодія міді з кислотами
а). У пробірку помістити шматочок мідного дроту і додати 5-7 крапель розведеної сульфатної кислоти. Помітних змін не протікає. Прилити у пробірку декілька крапель гідроген пероксиду і трохи нагріти. Відмітить що спостерігається. Написати відповідну реакцію.
б). У три пробірки помістити по шматочку мідного дроту і додати по 5-7 крапель у першу концентровану сульфатну кислоту, у другу – розведену нітратну кислоту, у третю – концентровану нітратну кислоту. Пробірки, в яких реакція на холоді не відбувається, злегка підігріти. Звернути увагу на колір і запах газів, що виділяються. Написати рівняння відповідних реакцій.
Дослід 2. Одержання купрум(ІІ) гідроксиду і його властивості
У три пробірки внести по 2-3 краплі купрум(ІІ) сульфату та додати в кожну з них краплями розчин натрій гідроксиду до випадіння драглистого осаду голубого кольору.
Вміст першої пробірки нагріти до кипіння. Відмітити зміну кольору осаду. У другу пробірку додати 3-4 краплі розчину сульфатної кислоти, у третю – 3-4 краплі концентрованого розчину натрій гідроксиду та нагріти. Відмітити що спостерігається? Написати відповідні рівняння реакцій.
Дослід 3. Окисні властивості похідних купрум (ІІ)
У пробірку внести 2-3 краплі розчину купрум (ІІ) сульфату та 2-3 краплі розчину калій йодиду. Спостерігати утворення осаду і забарвлення розчину в пробірці у жовтий колір.
Відлити частину суміші у пробірку, розбавити водою і додати 1-2 краплі крохмалю, відмітити появу синього забарвлення, яке свідчить про наявність у розчині йоду. Для встановлення кольору осаду Cu2I2 додати в пробірку краплями розчин натрій тіосульфату або натрій сульфіту до зникнення жовтого забарвлення.
Написати рівняння реакцій.
Дослід 4. Гідроліз солей купруму (ІІ)
а). На синій лакмусовий папірець нанести 2 краплі розчину купрум(ІІ) сульфату. Як змінився колір лакмусу? Сильною чи слабкою основою є Cu(OH)2? Написати рівняння реакції гідролізу солі міді в молекулярному та йонному вигляді.
б). У пробірку внести 2-3 краплі концентрованого розчину купрум (ІІ) сульфату і додати 2-3 краплі розчину натрій карбонату. Спостерігати утворення (СuОН)2СО3 та виділення газу. Написати рівняння реакції сумісного гідролізу солей в молекулярному та йонному вигляді.
|
|
Дата добавления: 2014-10-31; Просмотров: 2509; Нарушение авторских прав?; Мы поможем в написании вашей работы!