
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида
|
|
|
|
Пример 2.
При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида.
Решение.
Чтобы определить, какой металл был сожжен, рассчитаем его молярную массу эквивалента по закону эквивалентов:
 =
=  = > mЭ(Ме) =
= > mЭ(Ме) = 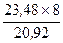 = 9 г/моль.
= 9 г/моль.
Молярная масса эквивалента кислорода равна 8 г/моль, а массу соединившегося с металлом кислорода определяем из соотношения:
m(Me2O3) = m(Me) + m(O2) = > m(O2) = 44,40 – 23,48 = 20,92 г.
Из формулы A(Me) = mЭ(Me) ´ n рассчитываем атомную массу металла:
AMe = 9 ´ 3 = 27 г.
По Периодической системе Д. И. Менделеева определяем, что металл с атомной массой 27 – алюминий. Формула оксида алюминия Al2O3. Его молярная масса эквивалента:
mЭ (Al2O3 ) = mЭ (Al) + mЭ (O2);
mЭ (Al2O3) = 9 + 8 = 17 г/моль.
Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
1. H2SO4 + 2NaOH = Na2SO4 + 2H2O.
2. 2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O.
3. Al(OH)3 + 3NaCl = AlCl3 + 3NaOH.
4. Zn(OH)2 + NaCl = ZnOHCl + NaOH.
Решение.
Молярные массы эквивалентов сложных веществ могут иметь различные значения (в зависимости от реакции, в которую они вступают).
Молярная масса эквивалента кислоты (гидроксида) равна ее молекулярной массе, деленной на количество атомов водорода (для гидроксида на количество OH- групп), замещенных в данной реакции другими атомами или ионами.
В первой реакции в молекуле серной кислоты 2 атома водорода замещаются на металл, во второй – 1 атом водорода фосфорной кислоты замещается на металл, поэтому
mЭ(H2SO4) = M(H2SO4) / 2 = 98 / 2;
mЭ(H2SO4) = 49 г/моль.
mЭ(Р3PO4) = M(H3PO4) / 1 = 98 / 1;
mЭ(H3PO4) = 98 г/моль.
Соответственно в 3-й и 4-й реакциях в гидроксидах замещаются на хлорид- ионы три и одна гидроксогруппы и их молярные массы эквивалентов равны:
mЭ [Al(OH)3] = M [Al(OH)3] / 3 = 78 / 3 = 26 г/моль;
mЭ [Zn(OH)2] = M [Zn(OH)2] / 1 = 99,4 / 1 = 99,4 г/моль.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1310; Нарушение авторских прав?; Мы поможем в написании вашей работы!