
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. Почему энергия двойной связи С = С (613,2 кДж) не равна удвоенному значению энергии одинарной связи С - С (348,6 кДж)?
|
|
|
|
Пример 2.
Почему энергия двойной связи С = С (613,2 кДж) не равна удвоенному значению энергии одинарной связи С - С (348,6 кДж)?
Решение.
Энергия связи в значительной мере зависит от способа перекрывания электронных облаков при образовании связи. Если область перекрывания лежит на линии связи - это s-связь. Если область перекрывания электронных облаков перпендикулярна линии связи, то это p-связь. s- и p-связи неравноценны по энергии, прочнее s-связь. Соединяющиеся атомы не могут образовывать между собой более одной s-связи. Поэтому одинарная связь С-С – это одна s-связь с энергией 348,6 кДж. 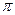 -связь двойной связи С=С равна 264,6 кДж, поэтому энергия двойной связи С=С не равна удвоенному значению одинарной связи С-С.
-связь двойной связи С=С равна 264,6 кДж, поэтому энергия двойной связи С=С не равна удвоенному значению одинарной связи С-С.
Как изменяется полярность связи и прочность молекул в ряду HF, HCl, HBr, HI?
Решение.
Если ковалентная связь образована при взаимодействии разных атомов, то электронное облако связи всегда смещается к атому с большей относительной электроотрицательностью и связь будет полярной, т. е. полярность связи зависит от электроотрицательности атомов. Чем больше разность относительных электроотрицательностей, тем полярнее связь. Элементы F, Cl, Br, I находятся в одной группе периодической системы Д. И. Менделеева. В группе электроотрицательность сверху вниз падает, значит, самый электроотрицательный элемент - фтор и поэтому связь в молекуле будет самой полярной.
Приведенные в условии задачи молекулы двухатомны, и прочность их определяется прочностью связи водород-галоген. Прочность же связи при прочих равных условиях зависит от длины связи, т. е. от радиуса атома галогена. По группе сверху вниз радиусы атомов увеличиваются, длина связи галогена с водородом растет, а прочность связи соответственно падает, так как чем длиннее связь, тем она менее прочна. Уменьшается и прочность молекул.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1631; Нарушение авторских прав?; Мы поможем в написании вашей работы!