
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. Какой процесс окисления или восстановления происходит при следующих превращениях:
|
|
|
|
Пример 2.
Какой процесс окисления или восстановления происходит при следующих превращениях:
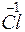
 ;
; 
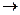
 ;
; 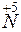
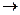
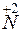 ;
;
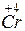
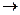
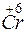 ;
; 
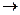
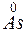 ;
; 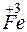
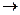
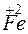 ?
?
Решение.
Повышение степени окисления происходит в результате отдачи электронов (окисления), понижение – за счет присоединения электронов (восстановления):
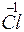
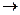
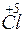
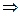
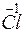 - 6
- 6 =
= 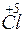 – окисление,
– окисление,
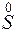

 - 8
- 8 =
= – окисление,
– окисление,

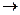

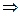
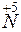 + 3
+ 3 =
=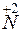 – восстановление,
– восстановление,
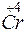
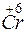
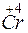 - 2
- 2 =
=  – окисление,
– окисление,

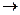
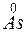
 - 3
- 3 =
= 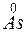 – окисление,
– окисление,
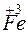
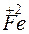
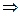
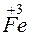 + 1
+ 1 =
= 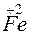 – восстановление.
– восстановление.
Реакция выражается схемами:
1. KClO3 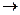 KClO4 + KCl.
KClO4 + KCl.
2. (NH4)2S + K2Cr2O7 + H2O 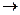 S + Cr(OH)3 + NH3 + KOH.
S + Cr(OH)3 + NH3 + KOH.
Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
Решение.
Для подбора коэффициентов уравнения воспользуемся методом электронного баланса.
1. Записываем уравнение реакции и находим атомы, меняющие степень окисления:
KCl+5O3 ® KCl+7O4 + KCl-1.
2. Составляем электронные уравнения и находим окислитель и восстано-витель:
Cl+5 – 2 = Cl+7, Cl+5 – восстановитель,
= Cl+7, Cl+5 – восстановитель,
Cl+5 + 6 = Cl–1, Cl+5 – окислитель.
= Cl–1, Cl+5 – окислитель.
В этом уравнении Cl+5(KClO3) является одновременно и окислителем, и восстановителем. Такая окислительно-восстановительная реакция называется реакцией диспропорционирования (самоокисления-самовосстановления).
3. Находим коэффициенты для окислителя, восстановителя и продуктов их превращения. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Для этого находим наименьшее общее кратное и множители:

 Cl+5 – 2
Cl+5 – 2 = Cl+7 3 (1)
= Cl+7 3 (1)
Cl+5 + 6 = Cl– 1 (2)
= Cl– 1 (2)
Ставим эти множители в уравнение (1). Перед KClO3 (Cl+5) ставится суммарный множитель (3 + 1 = 4). Коэффициенты у формул остальных веществ подбираются как обычно, путем сопоставления числа атомов в правой и левой частях уравнения:
|
|
|
4KClO3 = 3KClO4 + KCl.
По той же методике расставим коэффициенты во втором уравнении:
3(NH4)2S–2 + K2Cr2+6O7 + H2O = 3S0 + 2Cr+3(OH)3 + 2KOH + 6NH3
 |  |
S–2 – 2 = S0 3
= S0 3
Cr+6 + 6 = 2Cr+3 1
= 2Cr+3 1
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 877; Нарушение авторских прав?; Мы поможем в написании вашей работы!