
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отобрать в колбу рассчитанный объем воды и тонкой струей во избежание разбрызгивания добавлять заранее отмеренный объем 98%-ного раствора H2SO4
б) n1(HCl) = n2(HCl)
c1V1 = c2V2
V1 = 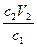 =
=  = 40 мл
= 40 мл
Поместить в мерную колбу на 200 мл 40 мл 0,5н раствора HCl, довести водой до метки при постоянном перемешивании
в) m1(H2SO4) = m2(H2SO4)
w1*r1*Vр1 = c( H2SO4)*M(
H2SO4)*M( H2SO4)*V2
H2SO4)*V2
Vр =  = 10,75 мл
= 10,75 мл
2.3. Приготовление растворов из фиксаналов.
Фиксанал – запаянная ампула, содержащая точное количество «х.ч.» вещества, взятого в виде навески или в виде его раствора.
Исходя из значения концентрации заданного раствора и количества вещества в фиксанале, рассчитать объем мерной колбы, перенести в нее с помощью бойка и воронки содержимое фиксанала, тщательно перемешать и довести водой до метки.
В некоторых случаях растворы готовят смешением двух растворов с различной концентрацией.
Пример:
Определите массовую долю HNO3 в растворе, полученном при смешении 200 мл 10%-ного раствора HNO3 (пл. = 1,05 г/мл) и 100 мл 20%-ного раствора HNO3 (пл. = 1,12 г/мл).
Решение:
w(HNO3) = 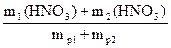
mp1(HNO3) = r1×V1 = 1,05×200 = 210 г
m1(HNO3) = w1× mp1 = 0,1×210 = 21 г
mp2(HNO3) = r2×V2 = 1,12×100 = 112 г
m2(HNO3) = w2× mp2 = 0,2×112 = 22,4 г
w(HNO3) =  = 0,1348 (13,48%)
= 0,1348 (13,48%)
Ответ: w(HNO3) = 13,48%.
Пример: Какие массы растворов КOH с w1 = 10% и w2 = 40% необходимо взять для приготовления 500 г 30%-ного раствора.
Решение:
Масса КОН в приготовленном растворе
m(KOH) = w×mp = 0,3×500 = 150 г
Масса КОН в исходных растворах:
m1(KOH) = w1×mp1 = 0,1× mp1
m2(KOH) = w2×mp2 = 0,4× mp2
Так как mp2 = mp – mp1, то
m2(KOH) = w2×mp2 = 0,4(500 – mp1) = 200 – 0,4× mp1
Так как m(KOH) = m1(KOH) + m2(KOH), то подставив известные данные, получим
150 = 0,1× mp1 + 200 – 0,4× mp1
Отсюда mp1 = 166,67 г; mp2 = 500 – 166,67 = 333,33 г
|
|
Дата добавления: 2014-10-31; Просмотров: 323; Нарушение авторских прав?; Мы поможем в написании вашей работы!