
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коллигативные свойства растворов. Коллигативными называются свойства растворов, не зависящие от природы частиц растворенного вещества
|
|
|
|
Коллигативными называются свойства растворов, не зависящие от природы частиц растворенного вещества, а зависящие только от концентрации частиц в растворе.
6.1. Осмос. Осмотическое давление
Осмос – самопроизвольная диффузия молекул растворителя через мембрану с избирательной проницаемостью.
Давление, которое нужно приложить к раствору для выравнивания скоростей взаимного проникновения молекул растворителя через полупроницаемую мембрану, называется осмотическим давлением (росм).
росм = cRT (кПа), где с – молярная концентрация.
Пример: Вычислите осмотическое давление 25%-ного раствора сахарозы при 15оС
(r = 1,105 г/мл).
Решение:
с = 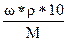 =
=  = 0,808 моль/л
= 0,808 моль/л
росм = 0,808*8,314*288 = 1,935*103 кПа
В водных растворах электролитов происходит увеличение числа частиц за счет процесса ионизации, поэтому для этих растворов при расчетах вводится изотонический коэффициент (i). Так, например, для электролита, распадающегося на два иона (KNO3, HCl и т.п.) максимальное значение коэффициента i при полной ионизации равно 2, для электролитов типа CaCl2, Na2SO4 и т.п. – 3, для FeCl3 – 4 и т.д.
Пример: В 250 мл раствора содержится хлорид калия массой 1,86 г. При 15оС осмотическое давление такого раствора равно 437 кПа. Вычислите изотонический коэффициент KCl в этом растворе.
Решение:
росм = icRT = i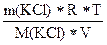
i = 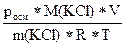 =
=  = 1,83
= 1,83
Применительно к сильным электролитам понятие степень ионизации носит условный характер. Опытным путем определяется так называемая кажущаяся степень ионизации, которая всегда ниже истинной ее величины, приближающейся в растворах сильных электролитов к единице. Это обстоятельство объясняется межионным взаимодействием в растворе, приводящим к образованию ионнных пар, которые ведут себя подобно молекулам, хотя и не являются таковыми. В общем виде связь между изотоническим коэффициентом и кажущейся степенью ионизации определяется соотношением:
|
|
|
i = 1 + a(k – 1) или 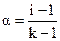 , где
, где
k – число ионов, образующих данный электролит.
Пример: Раствор KIO3, в 500 мл которого содержится 5,35 г соли, оказывает при 17,5оС осмотическое давление, равное 221 кПа. Вычислите коэффициент i и кажущуюся степень ионизации в растворе.
Решение:
i =  =
= 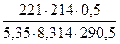 = 1,83
= 1,83
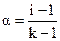 =
=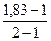 = 0,83 (83%)
= 0,83 (83%)
Растворы с одинаковым осмотическим давлением называются изотоническими. В случае контакта двух растворов с разным осмотическим давление гипертоническим будет называться раствор с большим осмотическим давлением, а гипотоническим – с меньшим осмотическим давлением. Осмотическое давление в организме постоянно и составляет 740-780 кПа (7,4-7,8 атм) при 37оС, что необходимо учитывать при приготовлении физиологических растворов, концентрацию которых называют осмолярностью (сосм = ic(X)).
Пример: Опишите поведение эритроцитов в: а) 0,9%-ном растворе NaCl (r = 1 г/мл); б) 0,5%-ном растворе NaCl (r = 1 г/мл); в) 2%-ном растворе NaCl (r = 1,013 г/мл)
(i = 1,9; t =37оС).
Решение:
а) с = 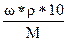 =
= 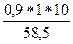 = 0,154 моль/л
= 0,154 моль/л
росм = icRT = 1,9*0,154*8,314*310 = 754 кПа
Раствор изотоничен крови.
б) с = 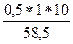 = 0,085 моль/л
= 0,085 моль/л
росм = 1,9*0,085*8,314*310 = 416 кПа
Раствор гипотоничен по отношению к крови, поэтому происходит эндоосмос: движение растворителя из раствора в эритроцит, что приводит к набуханию и разрушению эритроцита (гемолиз).
в) с =  = 0,346 моль/л
= 0,346 моль/л
росм = 1,9*0,346*8,314*310 = 1694 кПа
Раствор гипертоничен по отношению к крови, поэтому происходит экзоосмос: движение растворителя из эритроцита в раствор, что приводит к сжатию эритроцита (плазмолиз).
На явлении осмоса основано действие некоторых слабительных средств (MgSO4*7H2O, Na2SO4*10H2O), которые за счет плохого всасывания стенками кишечника создают в нем гипертоническую среду, вызывая тем самым поступление большого количества воды и послабляющее действие.
|
|
|
6.2. Давление пара растворителя над разбавленными растворами.
Согласно закону Рауля относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно молярной доле растворенного вещества.
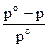 =
= 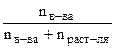
Пример: Определите при 65оС давление пара над раствором (р), содержащим 12 г сахарозы в 90 г воды, если давление пара над водой (ро) при той же температуре равно 25 кПа.
Решение:
n(C12H22O11) = 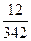 = 0,035 моль; n =(Н2О) =
= 0,035 моль; n =(Н2О) = 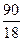 = 5 моль
= 5 моль

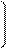
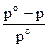 =
= 
р = ро – ро 
р = 25 – 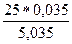 = 24,826 кПа
= 24,826 кПа
6.3. Температура кипения и кристаллизации растворов.
Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению. Т.к. в соответствии с законом Рауля давление насыщенного пара над раствором меньше, чем над растворителем, то температура кипения раствора будет выше, чем у растворителя. Температура замерзания раствора (из раствора кристаллизуется растворитель) более низкая по сравнению с растворителем.
Повышение температуры кипения или понижение температуры замерзания растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
DТкип = Есm(Х); DТзам = Ксm(Х), где
Е, К – эбулиоскопическая и криоскопическая константы, значения которых зависят только от природы растворителя.
Для электролитов:
DТкип = iЕсm(Х); DТзам = iКсm(Х)
Пример: Вычислите температуры кипения и замерзания 3%-ного раствора глицерина.
Решение:
сm(С3Н8О3) = 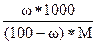
сm(С3Н8О3) = 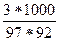 = 0,336 моль/кг
= 0,336 моль/кг
Для Н2О: Е = 0,52, К = 1,86;
DТкип = 0,52*0,336 = 0,174 К
tкип = 100 + 0,174 = 100,174оС
DТзам = 1,86*0,336 = 0,625 К
tзам = 0 – 0,625 = – 0,625оС
Эбулиоскопия и криоскопия используются для экспериментального определения молярных масс растворенных веществ
DТкип = Е*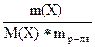 ; М =
; М = 
М = 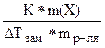
Пример: При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения повысилась на 0,453 К. Определите молярную массу растворенного вещества (Х).
Решение:
М = 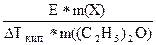 =
= 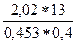 = 145 г/моль
= 145 г/моль
Пример: Раствор KNO3, содержащий 8,44% соли, показывает прирост температуры кипения на 0,797о по сравнению с температурой кипения воды. Вычислите кажущуюся степень ионизации соли в растворе.
|
|
|
сm(KNO3) = 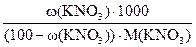
сm(KNO3) = 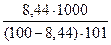 = 0,913 моль/кг
= 0,913 моль/кг
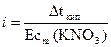 =
= 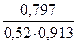 = 1,679
= 1,679
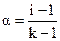 =
=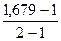 = 0,679 (67,9%)
= 0,679 (67,9%)
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 3737; Нарушение авторских прав?; Мы поможем в написании вашей работы!