
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные равновесия в растворах солей. Гидролиз солей
|
|
|
|
9.1. Состав продуктов реакции гидролиза. Качественная оценка реакции среды в растворах солей.
Гидролиз – обменное взаимодействие между ионами соли и водой.
В реакцию гидролиза вступают:
а) соли, образованные слабой кислотой и сильным основанием (KNO2, Na3PO4, K2S, K2SO3, Na2CO3 и т.д.)
Например:
I ст. K2S + H2O Û KHS + KOH
S2– + H2O Û HS– + OH– pH > 7;
II ст. KHS + H2O Û KOH + H2S
HS– + H2O Û H2S + OH–
б) соли, образованные сильной кислотой и слабым основанием (NH4Cl, CuSO4, ZnCl2, Fe(NO3)3 и т.д.).
Например
I ст. 2CuSO4 + 2H2O Û (CuOH)2SO4 + H2SO4
Cu+2 + H2O Û CuOH+ + H+ pH < 7
II ст. (CuOH)2SO4 + 2H2O Û 2Cu(OH)2 + H2SO4
CuOH+ + H2O Û Cu(OH)2 + H+
в) соли, образованные и слабым основанием, и слабой кислотой (NaNO2, NH4CN, (NH4)2S)
Например:
I ст. (NH4)2S + Н2О Û NH4OH + NH4HS
2NH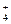 + S2– + H2O Û NH4OH + NH
+ S2– + H2O Û NH4OH + NH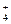 + HS–
+ HS–
II ст. NH4HS + H2O Û NH4OH + H2S
NH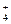 + HS– + H2O Û NH4OH + H2S
+ HS– + H2O Û NH4OH + H2S
Для оценки значений рН растворов в этих случаях сравнивают значения рКа (кислоты) и рКВ (основания), получающихся в результате гидролиза. Если рКа < рКВ, то среда слабокислая, рКа > рКВ – среда слабощелочная.
Процесс гидролиза обратим, но известны случаи и необратимого гидролиза, если:
а) в растворе одновременно идет гидролиз и по катиону, и по аниону;
б) два или более продуктов выводятся из сферы реакции в виде осадка, газа, слабого электролита;
в) продукты совместного гидролиза (Н+ и ОН–) взаимодействуют с образованием слабого электролита – Н2О, в результате чего равновесие смещается вправо, например, Al2S3, Fe2(CO3)3 и т.д.
Al2S3 + 6Н2О ® 2Al(OH)3 + 3H2S
В растворах эти соли не существуют, на что указано в таблице растворимости, поэтому в реакциях ионного обмена они образуются.
2CrCl3 + 3Na2CO3 + 6H2O ® 2Cr(OH)3 + 3CO2 + 6NaCl

 Cr+3 + H2O Û CrOH2+ + H+
Cr+3 + H2O Û CrOH2+ + H+
Þ H+ + OH– ® Н2О
 CO
CO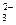 + H2O Û HCO
+ H2O Û HCO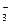 + OH–
+ OH–
9.2. Количественные характеристики гидролиза.
|
|
|
Для количественной оценки реакции гидролиза используют значения констант гидролиза, степени диссоциации, рН растворов солей.
9.3. Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
А– + НОН Û НА + ОН–
Кр = 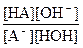 , т.к. [H2O] ~ const, то Кр [H2O] = const, это произведение называют константой гидролиза (Кг)
, т.к. [H2O] ~ const, то Кр [H2O] = const, это произведение называют константой гидролиза (Кг)
Кг = Кр[H2O] = 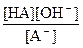
После некоторых математических преобразований получим:
Кг = 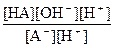 =
= 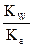 ;
;
Из уравнения реакции гидролиза [HA] = [OH–]. Так как соли – сильные электролиты, то можно принять, что [A–] ~ ссоли, тогда
Кг =  , отсюда [OH–] =
, отсюда [OH–] = 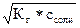
Степень гидролиза (h) – отношение числа ионов, подвергшихся гидролизу, к общему числу введенных в раствор ионов.
h = 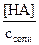 =
=  , отсюда [OH–] = h*ссоли
, отсюда [OH–] = h*ссоли
h можно рассчитать по другой формуле
h =  =
= 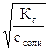
Пример: Рассчитайте рН, степень гидролиза и константу гидролиза 0,1М раствора СН3СООNa (Т = 298 К).
Решение: СН3СООNa + H2O Û CH3COOH + NaOH
Кг = 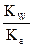 =
=  = 5,75*10–10;
= 5,75*10–10;
[OH–] = 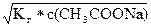 =
= 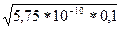 = 7,58*10–6 моль/л
= 7,58*10–6 моль/л
рН = 14 + lg[OH–] = 8,88
h = 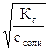 =
=  = 7,58*10–5
= 7,58*10–5
9.4. Гидролиз солей, образованных слабым основанием и сильной кислотой.
Рассмотрим на примере гидролиза соли NH4Cl
NH4Cl + H2O Û NH4OH + HCl
NH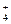 + H2O Û NH4OH + H+
+ H2O Û NH4OH + H+
Кр =  , отсюда Кг = Кр[H2O] =
, отсюда Кг = Кр[H2O] =  ;
;
после математических преобразований получим:
Кг = 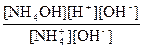 =
= 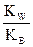 ;
;
Так как [NH4OH] = [H+], а [NH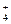 ] @ [NH4Cl] = ссоли, то
] @ [NH4Cl] = ссоли, то
Кг =  , а [H+] =
, а [H+] = 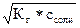
h = 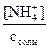 =
= 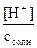 =
=  =
= 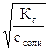 .
.
Соответственно, [H+] = h*cсоли
Пример: Рассчитайте рН, степень гидролиза и константу гидролиза 0,01М раствора NH4NO3.
Решение:
NH4NO3 + H2O Û NH4OH + HNO3
Кг = 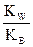 =
=  = 5,56*10–10
= 5,56*10–10
[H+] = 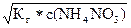 = =
= = 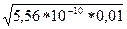 = 2,36*10–6 моль/л
= 2,36*10–6 моль/л
рН = –lg[H+] = – lg2,36*10–6 = 5,63
h =  =
= 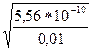 = 2,36*10–4
= 2,36*10–4
9.5. Гидролиз солей, образованных слабой кислотой и слабым основанием.
Рассмотрим на примере гидролиза соли NH4CN
NH4CN + H2O Û NH4OH + HCN
NH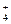 + CN– + H2O Û NH4OH + HCN
+ CN– + H2O Û NH4OH + HCN
Кр = 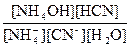 Þ Кг = Кр[H2O] =
Þ Кг = Кр[H2O] = 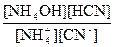
После математических преобразований получим
Кг = 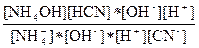 =
=  =
= 
9.6. Влияние различных факторов на степень гидролиза.
Глубина протекания гидролиза солей зависит от:
1) природы веществ;
2) концентрации растворов;
|
|
|
3) температуры;
4) рН среды.
9.7. Чем слабее кислота или основание, образующее соль, тем полнее протекает гидролиз.
Пример: Укажите, не производя вычислений, рН какого из растворов двух солей одинаковой концентрации ниже (выше): а) FeCl2 и FeCl3; б) Na2CO3 и NaHCO3.
Решение:
а) FeCl2 + H2O Û FeOHCl + HCl (1)
Fe+2 + H2O Û FeOH+ + H+
FeCl3 + H2O Û FeOHCl2 + HCl (2)
Fe+3 + H2O Û FeOH2+ + H+
Cтепень диссоциации (FeOH)2+ меньше, чем (FeOH)+, следовательно, равновесие процесса гидролиза FeCl3 в большей степени смещено вправо, чем FeCl2, поэтому рН2 < рН1.
б) Na2CO3 + H2O Û NaHCO3 + NaOH (1)
CO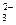 + H2O Û
+ H2O Û  + OH–
+ OH–
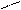 H2O
H2O
NaHCO3 + H2O Û NaOH + H2CO3 (2)
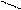 CO2
CO2
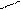 H2O
H2O
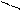 HCO
HCO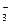 + H2O Û OH– + H2CO3
+ H2O Û OH– + H2CO3
CO2
Степень диссоциации Н2СО3 по I ступени больше, чем по II, следовательно HCO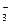 , образующийся на I ступени гидролиза, более слабый электролит, чем Н2СО3, образующийся на II ступени гидролиза, следовательно гтдролиз Na2CO3 протекает более полно, чем NaHCO3 и рН1 > рН2.
, образующийся на I ступени гидролиза, более слабый электролит, чем Н2СО3, образующийся на II ступени гидролиза, следовательно гтдролиз Na2CO3 протекает более полно, чем NaHCO3 и рН1 > рН2.
9.8 Связывая образующиеся в результате реакции ионы Н+ или ОН– в слабый электролит Н2О за счет, соответственно, увеличения или уменьшения рН среды, можно сместить равновесие процесса вправо, увеличить степень гидролиза.
Пример: Каким образом можно: а) увеличить степень гидролиза AlCl3; б) уменьшить степень гидролиза Na2S?
Решение:
а) AlCl3 + H2O Û AlOHCl2 + HCl
Al+3 + H2O Û AlOH2+ + H+
Сместить равновесие вправо, т.е. увеличить степень гидролиза, можно за счет разбавления раствора, повышения температуры и увеличения рН среды.
б) Na2S + H2O Û NaOH + NaHS
S2– + H2O Û HS– + OH–
Сместить равновесие влево, т.е. уменьшить степень гидролиза, можно за счет увеличения концентрации раствора, понижения температуры и увеличения рН среды.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2042; Нарушение авторских прав?; Мы поможем в написании вашей работы!