
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения. 178. Напишите координационные формулы комплексных соединений и назовите их, если координационное число комплексообразователя равно шести: а) CrCl3*5H2O; б)
|
|
|
|
178. Напишите координационные формулы комплексных соединений и назовите их, если координационное число комплексообразователя равно шести:
а) CrCl3*5H2O; б) NiCl2*6NH3; в) CoCl3*5NH3* H2O.
179. Для указанных комплексных соединений определите заряд внутренней сферы, степень окисления центрального атома, заряд лигандов и их дентатность. Дайте названия: [Cr(NH3)6]SO4; K2[Zn(OH)4]; K3[Fe(CN)6]; [Fe(CO)5]; [Pt(NH3)4Cl]Cl3; [Co(NH3)3(NO2)3]; [Cr(H2O)3Cl3].
180. Укажите тип гибридизации атомных орбиталей центрального атома в комплексных соединениях и геометрическую конфигурацию комплексных ионов: [Cr(NH3)6]3+; [Pt(NH3)4]2+; [Fe(CN)6]4+; [Ag(NH3)2]+.
181. Напишите уравнения диссоциации комплексных соединений: [Zn(NH3)4]SO4; K2[Hg(CN)4]; [Co(NH3)6]Cl3, математическое выражение Кн и укажите, какой из комплексных ионов является наиболее прочным, если их Кн соответственно равны: 4*10–10; 4*10–41; 8*10–6.
182. Объясните, почему [CoF6]3– парамагнитен, а ион [Co(CN)6]3– – диамагнитен. Определите пространственные конфигурации этих ионов.
183. Определите пространственные конфигурации комплексных ионов [Ag(NH3)2]+ и [Zn(NH3)4]2+.
184. Пользуясь таблицей значений Кн, определите в каких случаях произойдет взаимодействие между растворами электролитов:
а) K2[CdCl4] + NH3*H2O; б) [Cd(NH3)4]Cl2 + KCN; в) K[Cu(CN)2] + KI. Напишите уравнения осуществимых реакций в молекулярной и ионной формах.
185. Определите пространственные конфигурации комплексных ионов [NiCl4]2–; [Ni(CN)4]2–, если известно, что первый из них парамагнитен, а второй – диамагнитен.
186. Определите тип гибридизации атомных орбиталей комплексообразователя и геометрическую форму комплексных ионов: а) [AgNH3)2]+ – диамагнитен; б) [Ni(CN)4]2– - диамагнитен.
187. В водном растворе находятся соединения Cd(NO3)2, H2O, NH3, KI, KCN. Используя справочные данные, определите, какие комплексные соединения будут образовываться в первую очередь? Напишите в молекулярном и ионном видах уравнения реакций, назовите полученные вещества.
|
|
|
188. Напишите уравнения реакций в молекулярной и ионной формах:
а) CuCO3 + NH3*H2O; б) Zn(OH)2 + NaOH; в) Al(OH)3 + NaOH.
189. Определите тип гибридизации атомных орбиталей комплексообразователя и геометрическую форму комплексных ионов: а) [Fe(CN)6]4– – диамагнитен; б) [Zn(OH)4]2– – диамагнитен.
190. Определите тип гибридизации атомных орбиталей комплексообразователя и геометрическую форму комплексных ионов: а) [Со(NН3)6]3+ – диамагнитен; б) [NiCl4]2– – парамагнитен.
191. Напишите в молекулярной и ионной формах уравнения обменных реакций, происходящих между: а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6]4 и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея ввиду, что образующиеся комплексные соли нерастворимы в воде.
192. Найдите заряды комплексных частиц и укажите среди них катионы, анионы и неэлектролиты: [Co(NH3)5Cl]; [Cr(NH3)4PO4]; [Ag(NH3)2]; [Cr(OH)6]; [Co(NH3)3(NO2)3]; [Cu(H2O)4].
193. Определите степень окисления комплексообразователя в следующих комплексных ионах: [Fe(CN)6]4–; [Ni(NH3)5Cl]+; [Co(NH3)2(NO2)4]–; [Cr(H2O)4Br2]+; [AuCl4]–; [Hg(CN)2]–; [Hg(CN)4]2–; [Cd(CN)4]2–.
194. Константа нестойкости иона [Ag(CN)2]– составляет 1*10–21. Вычислите концентрацию ионов серебра в 0,05М растворе K[Ag(CN)2], содержащем, кроме того, 0,01 моль/л KCN.
195. В растворе соли состава CoCO3Cl4×NH3 не обнаружены NH3 и ионы 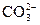 . Весь хлор, содержащийся в составе этой соли, образует AgCl. Измерение электрической проводимости приводит к заключению, что молекула соли распадается на два иона. Каково координационное строение соли? Определите степень окисления центрального атома и дентатность иона CO
. Весь хлор, содержащийся в составе этой соли, образует AgCl. Измерение электрической проводимости приводит к заключению, что молекула соли распадается на два иона. Каково координационное строение соли? Определите степень окисления центрального атома и дентатность иона CO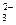 ?
?
196. Вычислите степени окисления платины, кобальта, олова, золота и никеля в комплексных ионах: а) [PtCl3(NO2)]2–; б) [PtCl(NH3)5]3+;
в) [Co(NH3)5NCS]2+; г) [SnF6]2–; д) [Au(CN)2Br2]–; е) [Pt(SO3)4]6–;
ж) [Ni(NH3)6]2+.
197. Координационные числа платины (II) и палладия равны четырем. Напишите уравнения диссоциации в растворе следующих комплексных соединений: а) PtCl4*4NH3; б) PtCl2*3NH3; в) PtCl2*2NH3;
г) PtCl2*KCl*4NH3; д) PtCl2*2KCl; е) PdCl2*2NH3*H2O; ж) PdCl2*2NH3. Какие из них практически малодиссоциированы?
|
|
|
198. Координационное число атома кобальта(III) равно шести. Напишите уравнения диссоциации в растворе следующих комплексных соединений:
а) CoBr3*4NH3*2H2O; б) CoCl3*4NH3; в) CoCl3*4NH3*H2O.
199. Какую пространственную конфигурацию имеют комплексные ионы [AgI2]– и [TiF6]2–? Какие гибридные орбитали комплексообразователей участвуют в образовании связей с лигандами?
200. Определите пространственную конфигурацию комплексных ионов:
а) [BeF4]2–; б) [AlF6]3–; в) [ClF2]–; г) [ICl4]–.
201. Определите геометрическое строение комплексных ионов. Какого типа гибридные орбитали комплексообразователя участвуют в образовании связей с лигандами: а) [CoCl4]–; б) [MnCl4]2–; в) [FeCl4]2–;
г) [Pt(NH3)4]2+ – диамагнитный; д) [PdCl4]2– – диамагнитный;
е) [Cu(NH3)4]2+; ж) [AuCl4]– – диамагнитный; з) [NiF4]2– – парамагнитный.
202. Определите геометрическое строение комплексных ионов. Какого типа гибридные орбитали комплексообразователя участвуют в образовании связей с лигандами: а) [Cu(NH3)2]+; б) [Cu(СN)3]2–; в) [Cu(СN)4]3–.
203. Определите геометрическое строение комплексных ионов. Какого типа гибридные орбитали комплексообразователя участвуют в образовании связей с лигандами: а) [Co(NH3)6]3+; б) [Co(NH3)6]2+; в) [Ti(H2O)6]3+; г) [Mn(CN)6]3–; д) [Fe(CN)6]3–; е) [NiF6]2–; ж) [NiF6]4–.
204. Определите концентрацию ионов серебра в 1 л раствора диамминсеребра(I) хлорида с концентрацией 0,01 моль/л в присутствии 1 моль аммиака. Что произойдет при добавлении к этому раствору 0,01 моль калий иодида? Ответ поясните.
205. Какую формулу имеет комплексное соединение, если при взаимодействии 1 моль его с избытком AgNO3 осаждается 1 моль AgCl?
206. Рассчитайте концентрацию ионов меди в 0,005М растворе сульфата меди(II) в присутствии 0,05 моль/л глицинат-ионов. Константа нестойкости образующегося комплекса [Cu(Гли)2] равна 5,6×10–16?
207. Вычислите концентрацию ионов кадмия в 0,1М растворе К2[Cd(CN)4], содержащем в избытке 0,1 моль KCN в 1 л раствора.
208. Вычислите концентрации ионов Zn2+ и [Zn(NH3)4]2+ в 0,1М растворе [Zn(NH3)4](NO3)2, содержащем дополнительно 0,8 моль/л аммиака (общая константа нестойкости К1–4 [Zn(NH3)4]2+ составляет 2,0×10–9,
К3–4 = 5,4×10–5).
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2444; Нарушение авторских прав?; Мы поможем в написании вашей работы!