КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особые химические свойства
|
|
|
|
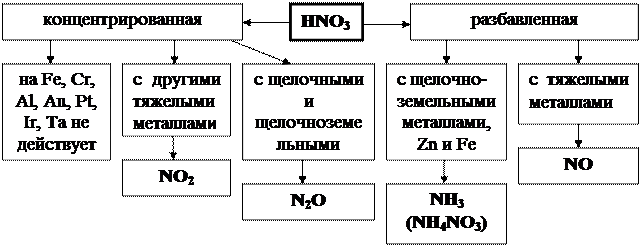 |
| Применение:изготовление минеральных удобрений, взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон. |
| Соли азотной кислоты – нитраты NaNO3; KNO3; NH4NO3; Ca(NO3)2 – селитры |
Разложение нитратов:
 ФОСФОР P
ФОСФОР P
| В природе:фосфат кальция – фосфорит. 3Ca3(PO4)2·CaF2 – фторапатит. Фосфор – в составе белковых веществ |
| Аллотропные модификации | |||||
Белый фосфор
Бесцветное ядовитое вещество. Не растворим в воде, растворим в сероуглероде. При слабом нагревании превращается в красный фосфор. Легко плавится, летуч.
Молекулярная кристаллическая решетка. | Красный фосфор Красноватый порошок, не ядовит, не растворим в воде и сероуглероде. Атомная кристаллическая решетка. Нелетуч. | Черный фосфор По внешнему виду похож на графит, жирный на ощупь, свойства полупроводника, неядовит. Атомная кристаллическая решетка. Нелетуч. |
| Химические свойства |
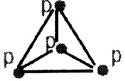
  Р взаимодействует с О2, S, галогенами, кислотами, водой
4P+5O2=2P2O5; 3O2+4P=2P2O3 (недостаток О2);
2P+3S=P2S3; 2P+5Cl2(изб.)=2PCl5 и PCl5+4H2O=H3PO4+5HCl;
3P+5HNO3+2H2O=3H3PO4+5NO;
4P+3NaOH+3H2O=PH3+3NaH2PO2;
2P+3Ca=Ca3P2 – Р – окислитель. Р взаимодействует с О2, S, галогенами, кислотами, водой
4P+5O2=2P2O5; 3O2+4P=2P2O3 (недостаток О2);
2P+3S=P2S3; 2P+5Cl2(изб.)=2PCl5 и PCl5+4H2O=H3PO4+5HCl;
3P+5HNO3+2H2O=3H3PO4+5NO;
4P+3NaOH+3H2O=PH3+3NaH2PO2;
2P+3Ca=Ca3P2 – Р – окислитель.
|
| Получение: 2Ca3(PO4)2+10C+6SiO2= =6CaSiO3+P4+10CO; t=1500˚C | Применение Р: красный фосфор – производство спичек; белый фосфор – для дымовых завес. |
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 482; Нарушение авторских прав?; Мы поможем в написании вашей работы!