
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры составления условий задач и их решения. Задача 669. Вычислите осмотическое давление раствора, содержащего
|
|
|
|
Задача 669. Вычислите осмотическое давление раствора, содержащего
в 1,4 л
63 г глюкозы C6H12O6 при 0 °С.
Решение:
Молярная масса глюкозы составляет 160 г/моль, следовательно, в 1,4 л раствора содержится количество вещества глюкозы
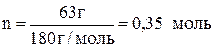 .
.
Осмотическое давление этого раствора глюкозы равно
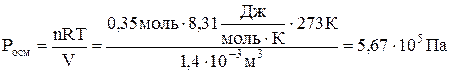 .
.
Дж = Па ∙ м3; 1л = 10 –3 м3.
Задача 683. Рассчитать молярную массу неэлектролита, если в 5 л раствора содержится 2,5 г растворенного вещества. Осмотическое давление этого раствора при 20 °С равно 0,23×105 Па.
Решение:
Молярную массу неэлектролита находим по формуле
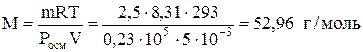 .
.
Задача 691. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NH2 в 10 г бензола.
Решение:
Из табл. 7 приложения находим эбулиоскопическую и криоскопическую константы бензола, соответственно равные 2,57 и 5,1 °С; температуру кипения чистого бензола 80,2 °С и температуру его замерзания 5,4 °С. Молярная масса нитробензола  = 123,1 г/моль.
= 123,1 г/моль.
По 2-му закону Рауля следует:
Dtкип= Kэ×m1×1000/M×m2=2,57×1×1000/123,1×10=2,09 °С.
Повышение температуры кипения раствора равно 2,09 °С, следовательно, температура кипения раствора равна 80,2 + 2,09 = 82,29 °С.
Понижение замерзания раствора нитробензола в бензоле:
Dtзам = Kэ×m1×1000/M×m2= 5,1×1×1000/123,1×10=4,14 °С.
Температура замерзания раствора Dtзам= 5,4° - 4,14° = 1,26 °С.
Задача 703.
Водный раствор спирта с массовой долей 15 %замерзает при
-10,26 °С. Вычислить молярную массу спирта.
Решение:
Из табл. 7 прил. находим криоскопическую константу воды 1,86 °С и температуру замерзания ее 0 °С. Понижение температуры замерзания раствора Dtэам р-ра = t зам. воды - t зам.р_ра= 0 - (-10,26) = 10,26°С. Из условия задачи следует, что на 15 г спирта приходится 85 г воды, и молярную массу спирта определяем, пользуясь соотношением
|
|
|
М = Кк× m1×1000/∆Tзам.×m2 = 1,86×15×1000/10,26×85= 32,0 г/моль.
Задача 723
Раствор, содержащий 2,3 г глицерина в 100 г ацетона, кипит при 56,73 °С. Вычислить молярную массу глицерина, если температура кипения чистого ацетона 56,3 °С.
Решение:
Повышение температуры кипения раствора Dtкип = 56,73-56,3= 0,43 °С. Молярную массу глицерина находим из соотношения:
М = КЭ× m1×1000/Dtкип m2 = 1,72×2,3×1000/0,43×100=92,0 г/моль
(эбулиоскопическая постоянная ацетона 1,72 oС).
В задачах 655–669 вычислить осмотическое давление водных растворов неэлектролитов
| № Задачи | Неэлектролит | Содержание | Объем раствора | Температура | Формула |
| 655. | – | 0,2 моль | 1л | ||
| 656. | – | 0,15 моль | 2л | ||
| 657. | – | 0,02 моль | - | ||
| 658. | – | 0,04 моль | - | ||
| 659. | сахар | 91 г | 1л | C12H22O11 | |
| 660. | глицерин | 46г | 3л | С3H5(OH)3 | |
| 661. | сахар | 68,4г | 3л | C12H22O11 | |
| 662. | анилин | 3,72г | 1л | C6H5NH2 | |
| 663. | глицерин | 0,736г | 0,4л | С3H5(OH)3 | |
| 664. | глюкоза | 90,08г | 4л | C6H12O6 | |
| 665. | сахар | 3% | - | C12H22O11 | |
| 666. | глицерин | 3% | - | С3H5(OH)3 | |
| 667. | метиловый спирт | 3г | 1л | CH3OH | |
| 668. | фенол | 0,1г | 2л | C6H5OH | |
| 669. | глюкоза | 63г | 1,4л | C6H12O6 |
В задачах 670–683 вычислить молярную массу растворенного вещества по следующим данным:
| № задачи | Масса растворенного вещества, г | Объем раствора | Температура, 0С | Осмотическое давление раствора |
| 0,55 0,7 0,046 3,04 4,88 0,4 6,34 3,2 2,0 6,33 2,3 2,8 2,5 | 500 мл 250 мл 100мл 600 мл 2 л 1 л 1 л 1л 0,5л 1л 100 мл 0,1л 0,2л 5л | 170,2 мм рт. ст 0,2 атм 0,112 атм 510,7 мм рт. ст 385,3 мм рт. ст 0,28 атм 3,55·105 Па 2,42·105 Па 0,51·105 Па 9·105 Па 243,4 кПа 618,5 кПа 0,7 кПа 0,23·105 Па |
(1мм рт. ст. = 133,3 Па; 1атм. = 1,01325∙105 Па = 101,325 КПа); 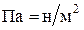 .
.
В задачах 684–696 вычислить температуру замерзания и кипения растворов
| № | Неэлектролит | Растворитель | |||
| Название | Формула | Содержание | Название | Содер- жание | |
| Нафталин Нафталин Сахар Глицерин Спирт этиловый Этиленгликоль Сахароза Нитробензол Глюкоза Нафталин Антифриз Сахароза Нафталин | C10H8 C10H8 C12H22О11 C3H5(ОH)3 C2H5ОH C2H4(ОH)2 C12H22О11 C6H5NO2 C6H12О6 C10H8 C2H4(ОH)2 C12H22О11 C10H8 | 1,05 г 0,2г 20г 9л;r=1261кг/см3 25% 500г 4,57 г 1г 10% 0,628г 35г 50% 4г | Вода Бензол Вода Вода Вода Вода Вода Бензол Вода Хлороформ Вода Вода Бензол | 30 г 26 г 400 г 30 л - 4 л 100 г 10 г - 20 г 100 г - 100 г |
В задачах 697–712 вычислить молярную массу растворенного вещества по понижению температуры замерзания растворов
|
|
|
| № задачи | Растворенное вещество | Растворитель | Dt | Температура замерзания р-ра, °С | ||
| Название | Масса, г | Название | Масса, г | |||
| Сера Камфора Неэлектролит Нафталин Неэлектролит Сера Спирт Спирт Неэлектролит Этиловый спирт Нафталин Мочевина Нафталин Вещество Неэлектролит Фосфор | 0,162 0,052 0,2 3,24 15% 6,55 1,05 8,74 0,0152 0,1 0,1155 | Бензол Бензол Бензол Вода Диэтило-вый эфир Бензол Вода Вода Вода Вода Камфора Вода Бензол Вода Камфора Бензол | 0,2568 19,03 | 0,081 0,067 0,318 0,453 0,81 0,2 | -1,45 -10,26 -0,53 -0,7 -0,354 156,5 -3,72 3,45 0,103 5,15 |
В задачах 713–728 вычислить молярную массу растворенного вещества по повышению температуры кипения растворов
| № | Растворенное вещество | Растворитель | Dt | Темп-pa кип. | |||
| название | масса, г | Название | масса, г | р-ра | p-ля | ||
| Антрацен Фосфор Сера Неэлектролит Иод Глицерин Фенол Хлороформ Сера Йод Глицерин Неэлектролит Неэлектролит Дифениламин Фосфор Салициловая к-та | 0,3027 1,08 5,12 6,4 9,2 9,2 0,94 0,81 12,7 2,3 55,4 0,062моль 0,2014 0,12 0,781 | Уксусная к-а Сероуглерод Бензол Диэтиловый эфир Метиловый спирт Ацетон Этиловый спирт Диэтиловый эфир Бензол Этиловый спирт Ацетон Вода Вода Бензол Сероуглерод Этиловый спирт | 28,95 2,5 л 200 мл 20,1 | 0,182 0,47 4,1 0,74 0,232 0,635 0,081 0,12 0,337 | 56,38 79,59 56,73 100,16 100,16 80,255 | 78,3 56,3 80,1 |
|
|
|
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 6232; Нарушение авторских прав?; Мы поможем в написании вашей работы!