
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Д. И. Менделеева
|
|
|
|
ЛЕКЦИЯ 2. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМНТОВ
ПСЭ - графическое выражение периодического закона
Д. И. Менделеева (1869 г.)
Современная формулировка закона:
свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Расположение элементов в ПС соответствует электронному строению их атомов.У каждого последующего элемента ПС на один е - больше, чем у предыдущего.
ПСЭ состоит из 7 периодов и 8 групп.
Период - горизонтальный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, е-- конфигурация которых изменяется от ns 1до ns 2 np 6(или до ns 2у элементов I периода).
1 период 1Н 1 s 1 2 период 3Li 1 s 22 s 1 или [Не]2 s 1 …2 s 1
2Не 1 s 2 4Be 1 s 22 s 2 или [Не]2 s 2 …2 s 2
Последний е - на который отличается данный атом от предыдущего называется формирующим электроном.По формирующему е- элементы подразделяются на 4 семейства: s -, p -, d - и f - элементов.
Первые 2 элемента любого периода - s- элементы.
56Ва …6 s 2  квантовые числа формирующего е -:
квантовые числа формирующего е -:
n = 6, l = 0, ml = 0, ms = + 1/2 или - 1/2
Краткая е- - формула любого s- элемента … ns1 ÷ 2
5B 1 s 22 s 22 p 1 или [Не]2 s 22 p 1 …2 s 22 p 1 
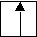


2 s 2 р квантовые числа формирующего е -:
n = 2, l = 1, ml = -1, 0, +1 (одно из значений), ms = + 1/2 или - 1/2
Краткая е- - формула любого p- элемента … ns 2 np1 ÷ 6
Любой период (кроме 1-ого) заканчивается формированием р – подуровня.
10Ne 1 s 22 s 22 p 6 или [Не]2 s 22 p 6
18Ar 1 s 22 s 22 p 6 3 s 23 p 6 или [Nе]3 s 23 p 6
3 период
заканчивается атомом 18Ar…3 s 23 p 6.
! Но формирование 3 – го квантового слоя незавершено.
4 период
начинается s -элементами 19К …4 s 1 и 20Са …4 s 2, т.к. энергетически более выгодно заполнение простой 4 s – орбитали.
Только после этого начинается заселение 3 d – подуровня.
|
|
|
21Sc 1 s 22 s 22 p 6 3 s 23 p 63 d 14 s 2 или [Ar]3 d 14 s 2 - d -элемент.
Краткая формула любого элемента …(n -1) d 1÷ 10 ns 1÷2
формирующий е -
21Sc …3 d 14 s 2 





3 d 4 s
квантовые числа формирующего е -:
n = 3, l = 2, ml = -2,-1, 0, +1,+2 (одно из значений), ms = + 1/2 или - 1/2
Начиная с 4 – го периода между s и р – элементами находятся десять d - элементов, у которых формируется предвнешний энергетический уровень (опоздание на 1 период).
30Zn [Ar] 3 d 104 s 2
d - элементы исключения: «провал» е- с подуровня ns в (n -1) d
Сr … 3 d 54 s 1 Ru … 4 d 75 s 1
Cu … 3 d 104 s 1 Rh … 4 d 85 s 1
Ag … 4 d 105 s 1 Pd … 4 d 105 s 0
Nb … 4 d 45 s 1 Pt … 5 d 96 s 1
Mo …4 d 55 s 1 Au … 5 d 106 s 1
Причина - более низкая Е экспериментально установленной конфигурации по сравнению с теоретической.
29Cu …3 d 94 s 2 теоретическая
29Cu …3 d 104 s 1 экспериментальная
В атомах f- элементов в последнюю очередь заполняется предпредвнешний энергетический уровень (опоздание на 2 периода).
6 период
55Cs …6 s 1 56Ba …6 s 2 57La …5 d 16 s 2
формирующий е -
58Ce …4 f 15 d 16 s 2 - f- элемент (семейство лантаноидов)
квантовые числа формирующего е -:
n = 4, l = 3, ml = -3,-2,-1,0, +1,+2,+3 (одно из значений), ms = + 1/2 или - 1/2
В 6 и 7 периодах между (n -1) d 1 ns 2 (n -1 d) 2 ns 2 находятся 14 f- элементов:
лантаноиды и актиноиды.
Теоретическая краткая формула f- элемента …(n -2) f 1÷14(n -1) d 1 ns 2
Экспериментальные е- - конфигурации многих f- элементов отличаются от теоретических вследствие эффекта «провала» е -.
Группа – совокупность элементов, атомы которых имеют одинаковое число е – на внешних и формирующихся подуровнях (валентных е -)
IV группа
Главная подгруппа (А) Побочная подгруппа (Б)
Сокращенная е- - формула
С … 2 s 22 p 2 Ti …3 d 24 s 2
Si …3 s 23 p 2 Zr …4 d 25 s 2
Ge …4 s 24 p 2 Hf …5 d 26 s 2
Sn …5 s 25 p 2 Rf …6 d 27 s 2
p - элементы d – элементы
Валентная конфигурация
… ns 22 p 2 … (n -1) d 2 ns 2
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 311; Нарушение авторских прав?; Мы поможем в написании вашей работы!