
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы идеальных растворов
Закон Рауля
Понижение Р насыщенного пара растворителя над раствором пропорционально молярной доле растворенного малолетучего компонента.
Р 0, Р – давления насыщенных паров растворителя над
растворителем и раствором, соответственно, [Па]
v 0, v – число молей растворителя и растворенного вещества.


ЗАДАЧА
Р н.п. чистого ацетона(СО(СН3)2) при 20º С равно 23940 Па. Р н.п. ацетона над раствором, содержащем 5 г камфоры на 200 г ацетона, при той же Т равно 23710 Па. Определите молекулярную массу камфоры.
Решение.
М (ацетона) = 58 г/моль. М камфоры – х г/моль.
Согласно закону Рауля:

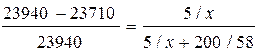 , откуда х = 151 г/моль.
, откуда х = 151 г/моль.
Следствия из закона Рауля:
· Растворы малолетучих веществ закипают при температуре выше Т кип чистого растворителя и замерзают (кристаллизуются) при температуре ниже Т зам чистого растворителя.
↑ Т кип - D Т кип и ↓ Т зам - D Т зам пропорционально моляльности раствора сm
|
D Т кип = Кэсm D Т зам = Кксm
Кэ , Кк - эбулиоскопическая и криоскопическая постоянные (характеризуют природу растворителя)
|
|
кг*К*моль -1 1,86 0,52
ЗАДАЧА
Вычислите Т кип и Т зам водного раствора глицерина с массовой долей С3Н8О, равной 5%. M (С3Н8О) = 92 г/моль.
Решение
В 100 г раствора: 5 г С3Н8О и 95 г Н2О.
В 1000 г Н2О:
m (С3Н8О)= (1000×5)/95 = 52,6 г.
v (С3Н8О) = m (С3Н8О)/ M (С3Н8О) = 52,6/92 = 0,57 моля.
Þ сm = 0,57 моль/1000 г Н2О.
Используя закон Рауля и справочные значения К э и К к для воды, находим:
ΔТ зам = 1,86 · 0,57 = 1,06º, Δ Т к = 0,52 · 0,57 = 0,29º,
Þ Т з = -1,06º С, Т к = 100,29º С.
Если известны:
ü экспериментально определенные D Т кип или D Т зам раствора
ü масса растворенного вещества mB и растворителя mР,
молярная масса растворенного вещества М В :
 , [г/моль] К º К Э либо К К.
, [г/моль] К º К Э либо К К.
ЗАДАЧА
Вычислите Т кип и Т зам водного раствора глицерина с массовой долей С3Н8О, равной 5%. M (С3Н8О) = 92 г/моль.
Решение
В 100 г раствора: 5 г С3Н8О и 95 г Н2О.
В 1000 г Н2О:
m (С3Н8О)= (1000×5)/95 = 52,6 г.
v (С3Н8О) = m (С3Н8О)/ M (С3Н8О) = 52,6/92 = 0,57 моля.
Þ сm = 0,57 моль/1000 г Н2О.
Используя закон Рауля и справочные значения К э и К к для воды, находим:
ΔТ зам = 1,86 · 0,57 = 1,06º, Δ Т к = 0,52 · 0,57 = 0,29º,
Þ Т з = -1,06º С, Т к = 100,29º С.
|
|
Дата добавления: 2014-10-31; Просмотров: 678; Нарушение авторских прав?; Мы поможем в написании вашей работы!