
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомно-кристаллическое строение металлов
|
|
|
|
А т о м н о е с т р о е н и е металлов и других элементов характеризуется, в основном, зарядом ядра и числом его электронных оболочек, что определяет кристаллическую структуру и свойства элементов. Основная масса атома сосредоточена в его ядре, которое состоит из имеющих заряд протонов и незаряженных нейтронов. Суммарный положительный заряд ядра численно соответствует номеру элемента в периодической системе Д. И. Менделеева и уравновешивается такой же величиной суммарного отрицательного заряда окружающих ядро электронов. Поэтому свободный атом в целом является электрически нейтральной системой.
Энергетическое состояние каждого из электронов характеризует их связь с ядром и движение вокруг ядра по определенным оболочкам сферической или эллипсоидной формы. На этих оболочках статистическое распределение величины заряда непрерывно движущегося электрона является неравномерным, чем создается электронное облако соответствующей конфигурации. Количество электронных оболочек атома определяет номер периода, к которому отнесен данный элемент в периодической системе.
Число электронов на внешней оболочке атома, которое может достигать восьми, характеризует номер группы данного элемента в периодической системе и определяет его валентность. Наибольшее влияние на кристаллическую структуру элемента оказывает форма электронных облаков, создаваемых внешними электронами.
Гипотеза о том, что в кристаллах существует пространственное, периодическое расположение атомов, впервые была выдвинута в 1860 году крупнейшим русским кристаллографом Е.С.Федоровым. И только в 1912 году немецкий физик М.Лауэ предложил пропустить через кристалл пучок рентгеновских лучей и, изучив получившуюся на фотопластинке дифракционную картину, дал математическую теорию этого явления, за что был удостоен Нобелевской премии. Результатами исследования стали экспериментальное подтверждение гипотезы о закономерном расположении атомов в кристаллах, доказанность волновой природы рентгеновских лучей и создание метода рентгеноструктурного анализа строения атома.
|
|
|
К р и с т а л л и ч е с к о е с т р о е н и е обусловлено значительными силами межатомной связи, возникающими за счет энергии взаимодействия электронов внешних атомных оболочек. Эта энергия Е притяжения и отталкивания имеет электростатическую природу, ее величина возрастает с повышением количества взаимодействующих электронов, а также с уменьшением расстояния r между центрами атомов (рис.1).
При температурах существования материала в расплавленном состоянии его атомы обладают повышенной энергией и совершают хаотичные перемещения, включая колебания около определенных положений и переходы в новые положения. Небольшие расстояния между атомами в этих условиях имеют порядок размеров самих атомов, поэтому атомы, взаимодействуя друг с другом, притягиваются, соударяются, обмениваются энергией и отталкиваются.
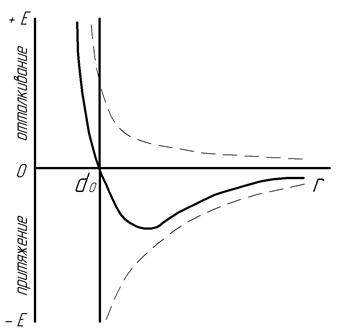
Рис. 1. Зависимость энергии взаимодействия двух атомов от расстояния между ними
В процессе охлаждения расплава тепловые колебания и перемещения атомов все более ограничиваются так, что на расстояниях r, превышающих межцентровую величину d0, энергия притяжения преобладает над энергией отталкивания и атомы сближаются. При малых расстояниях r начинает быстрее возрастать энергия отталкивания и, когда произойдет касание внешних электронных оболочек на расстоянии d0, результирующая энергия взаимодействия атомов становится минимальной. В таком случае при остывании материала они занимают равновесное, устойчивое положение, потому что для перехода атомов из этого состояния необходимо преодолеть значительную энергию их отталкивания либо притяжения. Этим создается периодическое пространственное расположение атомов на расстояниях d0 с минимальным запасом свободной энергии, что и представляет кристаллическое строение материалов. Указанное постоянное положение атомов распространяется на значительные расстояния и характеризует их дальний порядок.
|
|
|
Если атомы расплава имеют малые значения энергии взаимодействия, то при охлаждении они не могут приобретать устойчивость, так как под воздействием внешних сил продолжают переходить в новые положения. После остывания такого расплава его атомы остаются расположенными хаотично, формируя аморфную структуру материала. При этом в небольших группировках атомов может возникать и разрушаться динамическое подобие их правильного расположения, составляя ближний порядок.
Сильная межатомная связь, создающая кристаллическую структуру элементов, в зависимости от числа электронов на внешней оболочке и количества электронных оболочек атома проявляется в нескольких основных видах
(рис. 2).
Металлическая связь возникает при наличии на внешней оболочке слабосвязанных с ядром валентных электронов, которые, легко перемещаясь по внешним оболочкам соседних атомов, становятся коллективизированными электронами (рис. 2, а). Отдавая свои валентные электроны в «коллективное пользование», атомы превращаются в положительные ионы, окруженные подобием электронного газа. Это создает кулоновские силы взаимодействия зарядов, что удерживает ионы-атомы в устойчивых положениях, формируя кристаллическую решетку типа электронного кристалла и придавая ему характерные металлические свойства.
Такой вид межатомной связи устанавливается при наличии на внешней оболочке менее четырех электронов и увеличенном общем количестве элетронных оболочек. Следовательно, у элементов, расположенных в периодической системе левее и ниже, усиливаются металлические свойства.
Ковалентная связь осуществляется в случае более сильного притяжения внешних электронов к ядру (рис. 2, б). При этом такие электроны двух или более атомов коллективизируются в пары, которые перемещаются одновременно по внешним оболочкам двух атомов. Кулоновские силы взаимодействия этих электронов с ядрами двух атомов обеспечивают парноэлектронную связь и устойчивость атомов в равновесном положении. При таких условиях образуется валентный кристалл со свойствами переходного типа между металлами и металлоидами.
|
|
|
Этот вид связи возникает у элементов с увеличенным до четырех-семи числом внешних валентных электронов и небольшим количеством внутренних электронных оболочек.
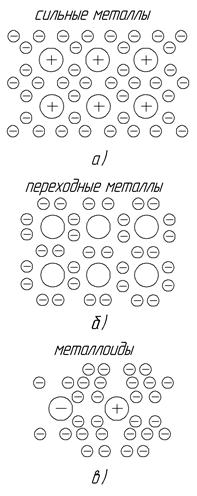
Рис. 2. Виды межатомной связи при образовании кристаллической структуры:
а – металлическая связь, б – ковалентная связь, в – молекулярная связь
Молекулярная связь появляется при условиях прочного сцепления внешних электронов с ядром и невозможности их перехода на оболочки других атомов с протеканием процесса коллективизации (рис.2, в). При сближении таких атомов происходит взаимодействие между их электрическими полями, из-за чего центр тяжести отрицательного заряда каждого атома смещается относительно положительного ядра, т.е. атомы поляризуются. В этом случае атомы удерживаются в равновесных положениях и создают кристалл благодаря более слабым, чем кулоновские, электростатическим силам Ван-дер-Ваальса, голландского ученого, впервые установившего действие таких молекулярных сил при исследовании газовых состояний. Они проявляются при взаимодействии как молекул, так и отдельных атомов, считающихся простейшей формой молекул. Поэтому образующуюся структуру называют молекулярный кристалл, его свойства соответствуют типичным металлоидам.
Молекулярный тип связи создается при наличии заполненной восемью электронами внешней оболочки и наименьшем количестве других оболочек, т. е. металлоидные свойства усиливаются у элементов, расположенных выше и правее в периодической системе.
Атомно-кристаллическое строение металлов и других материалов рассматривается с использованием пространственной модели жестких шаров, располагаемых в местах устойчивого состояния атомов. Соединение центров таких шаров воображаемыми линиями позволяет представить кристаллическую решетку, в которой точки пересечения линий называются узлами. Решетка состоит из множества повторяющихся простых многогранников – элементарных ячеек, форма которых зависит от конфигурации электронных оболочек атомов. При достаточно большом количестве ячеек кристаллическая решетка приобретает визуально заметный объем, который по геометрической форме подобен ячейке и называется кристаллом.
|
|
|
Классификация кристаллов производится по степени симметрии их формы в отношении кристаллографических осей x, y, z, проведенных под углами a, b, g через центр ячейки и пересекающихся с ее гранями (рис. 3). На этих осях отсекаются гранями ячейки отрезки a, b, c, противолежащие соответствующим углам между осями и называемые параметрами решетки.
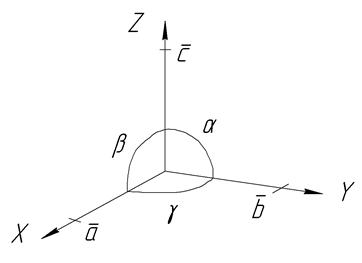
Рис. 3. Углы между кристаллографическими осями и отрезки, отсекаемые
на них гранями ячейки
В зависимости от соотношений между величинами параметров a, b, c и значениями углов a, b, g образуются различные степени симметрии решетки, которые позволяют выделить несколько основных кристаллографических систем (рис. 4).
1. Кубическая: все углы равны 90°, все параметры одинаковы, типичный многогранник – куб (рис. 4, а).
2. Гексагональная: все горизонтальные параметры равны между собой и перпендикулярны к неравному им вертикальному параметру, типичный многогранник – шестигранная призма (рис.4, б).
3.Тетрагональная: все углы прямые, два параметра равны друг другу и не равны третьему, типичный многогранник – квадратный параллелепипед (рис.4, в).
4. Ромбическая: все углы прямые, все параметры не равны между собой, типичный многогранник – прямоугольный параллелепипед с неквадратными сторонами (рис.4, г).
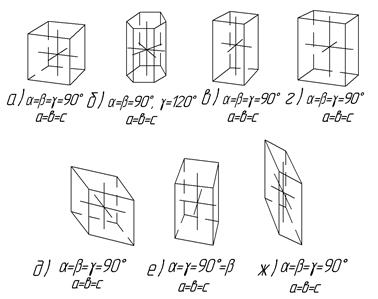
Рис. 4. Виды кристаллографических систем: а – кубическая, б – гексагональная,
в – тетрагональная, г – ромбическая, д – ромбоэдрическая, е – моноклинная,
ж – триклинная
5. Ромбоэдрическая: все углы равны между собой, но не равны 90°, все параметры равны, типичный многогранник – ромбоэдр (рис.4, д).
6. Моноклинная: одна из осей наклонна (b№90°), все параметры неравны, типичный многогранник – параллелепипед (рис.4 е).
7. Триклинная: все углы не прямые и неравные между собой так же, как и параметры, типичный многогранник – косоугольный параллелепипед (рис.4 ж).
Кроме рассмотренных семи видов простых кристаллографических систем, где атомы находятся в вершинах многогранников, существуют четырнадцать типов кристаллических решеток с дополнительными атомами, расположенными внутри многогранников. Такие решетки являются плотноупакованными, они наиболее характерны для большинства технически важных металлов: Fe, Al, Cu, Mg, Ti, Zn, Sn, Co, Ni. Это объясняется особенностью межатомной металлической связи, которая проявляется сильнее, когда электроны могут легче перемещаться по внешним оболочкам наиболее плотно расположенных атомов.
К самым распространенным типам плотноупакованных решеток относятся объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК), гексагональная плотноупакованная (ГПУ) (рис.5).
Взаимное расположение атомов в таких решетках определяет свойства металла и характеризуется несколькими основными показателями.
Период решетки а представляет расстояние между центрами ближайших атомов в вершинах ячейки и измеряется в специальных кристаллографических единицах «ангстремах» – 1 Å = 10-10 м. (рис. 5). Величина периода обычно находится в пределах от 1Å до 7Å.
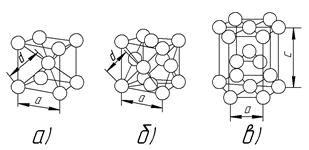
Рис. 5. Основные типы плотных кристаллических решеток:
а – объемноцентрированная кубическая, б – гранецентрированная кубическая,
в – гексагональная плотноупакованная
В простой кубической ячейке период а равен двум радиусам атомов, т. е. диаметру d атома. В плотных кубических решетках диаметр атома соответствует расстоянию между атомом в вершине и атомом в центре ячейки либо в центре грани, поэтому период таких решеток превышает диаметр атома (рис. 5а, б).
В гексагональной и тетрагональной решетках учитывается также расстояние с – длина ребра призмы или параллелепипеда (рис. 5, в). Показателем плотности является величина с/а, которая для решетки ГПУ составляет 1,633, если с/а № 1,633, решетка считается неплотной. Для тетрагональной решетки величина с/а определяет степень ее тетрагональности.
Базис решетки Б характеризуется числом ее атомов, принадлежащих целиком или частично одной ячейке.
Координационное число К указывает, каково наибольшее количество атомов, расположенных на одинаковых, ближайших расстояниях от каждого атома. Это число в значительной мере определяет характеристики структуры и свойств материалов. Так, его высокие значения обусловливают металлические свойства, при малых значениях формируются свойства металлоидов.
Коэффициент компактности Д определяет плотность упаковки атомов в ячейке и показывает, какую долю всего объема ячейки занимают атомы, оставляя соответствующую долю на пустоты между ними.
С увеличением числовых значений рассмотренных характеристик решеток, в соответствии с показателями табл. 1 для технически важных металлов, повышается их термодинамическая устойчивость, улучшаются многие физико-механические свойства.
К р и с т а л л о г р а ф и ч е с к и е п л о с к о с т и и н а п р а в л е н и я в решетке характеризуют различные виды упорядоченности расположения атомов и обозначаются определенными числовыми индексами. Это используется при исследованиях и описаниях энергетических процессов в кристаллических материалах, изменений их физико-химических и механических свойств.
Координаты атомов кристаллической решетки устанавливаются путем выбора начала координат в одном из ее атомных узлов. При этом на координатных осях получаются отрезки а, в, с, равные длине ребер кристаллической ячейки и составляющие осевую еденицу. В таких условиях координаты атомов решетки обозначаются простыми числами с положительным либо отрицательным знаком в квадратных скобках вида [ m n p ], пропорционаьными осевой еденице. Например, в решетке ОЦК координаты атома в центре куба обозначаются числами [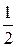
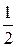
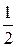 ], координаты атома верхней грани куба, находящегося в конце ребра, параллельного оси y, обозначаются числами [011] (рис.6, а).
], координаты атома верхней грани куба, находящегося в конце ребра, параллельного оси y, обозначаются числами [011] (рис.6, а).
Кристаллографические плоскости размещаются в решетке так, чтобы в каждой из них содержалось не менее трех узловых атомов. Положение таких плоскостей в решетке определяется длинами отрезков, отсекаемых каждой плоскостью на выбранных координатных осях и выраженными в осевых еденицах. Для обозначения плоскостей используются кристаллографические индексы в круглых скобках вида (h k l), которые представляют простые целые числа, обратно пропорциональные длинам отрезков на координатных осях, согласно общему уравнению плоскости из аналитической геометрии.
Например, в решетке ОЦК имеются три плоскости граней куба, каждая из которых пересекает одну координатную ось, при этом отсекаемые на трех осях отрезки имеют длину (1, ∞, ∞), (∞, 1, ∞), (∞, ∞, 1) (рис. 6, б). Перейдя к обратным значениям длин отрезков, получим индексы данных плоскостей (100), (010), (001). Плоскость, проходящая по вертикали через диагональ куба и представляющая грань ромбического додекаэдра, характеризуется индексами (110), плоскость в виде грани октаэдра – индексами (111) (рис. 6, в, г).
Совокупность кристаллографически идентичных плоскостей с однотипными индексами (включая их отрицательные значения) и одинаковым межплоскостным расстоянием обозначается индексами одной из данных плоскостей, заключенными в фигурные скобки. Например, индексы для совокупности плоскостей граней куба – {100}, для совокупности октаэдрических плоскостей – {111}.
Кристаллографические направления представляют прямые, проходящие в решетке не менее чем через два узловых атома так, что все атомы, лежащие на данной прямой, находятся на одинаковых расстояниях друг от друга. Выбрав начало координат в одном из этих атомных узлов, устанавливают координаты любого атома данной прямой. Индексы направления при этом обозначаются простыми целыми наименьшими числами, пропорциональными найденным координатам атома, в квадратных скобках вида [ u v w ]. Так, в решетке ОЦК индексы направлений осей координат совпадают с индексами плоскостей граней куба и представляют [100], [010], [001], индексы направлений диагоналей граней обозначаются [101], [011], [110], индексы направления диагонали куба – [111] (рис. 6, д).
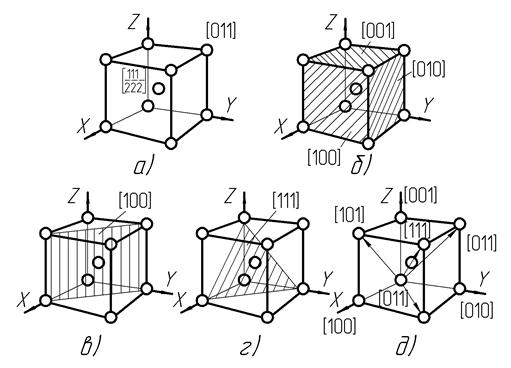
Рис.6. Основные кристаллографические координаты, плоскости и направления решетки ОЦК: а – координаты атомов, б – индексы плоскостей граней куба; в – индексы вертикальной диагональной плоскости куба; г – индексы наклонной диагональной плоскости куба; д – индексы направлений куба
Совокупность кристаллографически идентичных параллельных направлений обозначается индексами одного из таких направлений, помещенных в угловые скобки. Например, индексы для совокупности направлений диагонали куба -  111
111 , для совокупности направлений диагонали грани -
, для совокупности направлений диагонали грани -  011
011 .
.
Гексагональная кристаллографическая система для обозначения атомных плоскостей и направлений требует применения четырех координатных осей с использованием четырехзначных числовых индексов.
А н и з о т р о п и я кристаллов характеризуется зависимостью их физико-механических свойств от нпарвления действия внешних факторов, что проявляется в однородном монокристалле с определенной геометрической ограненной формой. Подобная неодинаковость свойств касается упругости, прочности, теплового расширения, теплопроводности, скорости света (в прозрачных кристаллах), скорости звука, что объясняется разной плотностью упаковки атомов в различных кристаллографических плоскостях и направлениях. Поэтому, например, под действием механической нагрузки на монокристалл его деформация легче начинается по плоскостям и направлениям с наиболее плотной упаковкой атомов. Это происходит как сдвиг тонких слоев – пачек – монокристалла относительно друг друга по таким плоскостям и направлениям – системам скольжения.
И з о т р о п и я аморфных материалов с хаотичным пространственным расположением атомов представляет одинаковость их свойств при различных направлениях воздействия внешних факторов. Это связано с однородной во всех направлениях плотностью упаковки атомов в аморфных материалах.
Металлические материалы состоят из множества анизотропных кристаллов с различной кристаллографической ориентацией и границами между ними, представляющих кристаллические зерна. Анизотропность каждого кристаллического зерна нивелируется анизотропностью соседних разориентированных зерен так, что свойства такого поликристаллического мтеалла не зависят от направления действующих факторов, и металл в целом является изотропным, или псевдоизотропным.
Если кристаллическим зернам придать одинаковую общую ориентацию, то структура металла приобретает направленность, называемую текстурой, чем создается анизотропия металла. Такая текстура может быть получена за счет воздействия на металл различными технологическими методами, например, обработкой давлением с протеканием процессов значительной холодной пластической деформации.
П о л и м о р ф и з м или а л л о т р о п и я предстаяляет способность некоторых металлов и других кристаллических элементов существовать в нескольких кристаллических формах, переходя из одной в другую при изменениях окружающей температуры либо при действии больших давлений. Эта способность связана со стремлением атомов занять в решетке положения с наименьшим запасом свободной энергии.
Полиморфные превращения происходят при определенных температурах и сопровождаются экзо- или эндотермическим эффектом. При этом происходит перекристаллизация, изменяются структурное состояние элемента, его основные физико-химические и механические свойства.
Таблица 1
Характеристики кристаллических решеток металлов
| Металл и его кристаллическая форма | Тип решетки | Период | База | Координац. число | Коэфф. компактности |
| Fea, Tib, Cr, Nb, Mo, W, C | ОЦК | 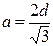
| Б2 | К8 | Д 0,68 |
| Feg, Nib, Cob, Cu, Ag, Au | ГЦК | 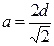
| Б4 | К12 | Д 0,74 |
| Tia, Coa, Nia, Mg, Zn, Cd | ГПУ | 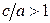
| Б6 | Г12 | Д 0,74 |
Полиморфизмом обладают такие технически важные металлы, как Fe, Ti, Co, Ni, Zn, Sn. Различные кристаллические формы одного металла можно расположить в модификационный ряд, начиная с самой низкотемпературной и применяя для них соответственные буквенные обозначения: a, b, g, d (табл. 1).
Кроме изменения структурного состояния, нагрев уменьшает магнитные свойства ферромагнитных металлов Fe, Ni, Co, так что при определенных температурах, соответствующих точке Кюри, у них происходит полная потеря магнитных свойств. Такое явление объясняется наличием у этих металлов магнитной структуры, самопроизвольно образованной доменами – макроскопическими участками, в которых электронные спины атомов располагаются параллельно и создают магнитный момент. При нарастании тепловых колебаний атомов доменная структура и магнитные свойства ферромагнетиков теряются, но восстанавливаются при последующем охлаждении.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 3041; Нарушение авторских прав?; Мы поможем в написании вашей работы!