
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состав мышечной ткани сельскохозяйственных животных 1 страница
|
|
|
|
| Наименование показателя | Содержание в мышечной ткани, % |
| Вода Сухой остаток, в том числе: белковые вещества липиды азотистые экстрактивные ве- щества углеводные компоненты минеральные вещества | 72 – 75 25 – 28 18 – 22 0,5 – 3,5 1,0 – 1,7 0,7 – 1, 3 0,8 – 1,8 |
В технологическом отношении практическое значение имеют питательная ценность белковых веществ и некоторые их свойства, от которых зависит их состояние и поведение под воздействием воды, электролитов, изменения рН среды, нагрева, окислителей и восстановителей и т.д.
В связи с тем, что человеческий организм не способен синтезировать некоторые аминокислоты, они должны поступать извне в составе незаменимого белкового минимума. В него входит определенное количество несинтезируемых, а, следовательно, незаменимых аминокислот. К ним относится валин, триптофан, лейцин, лизин, изолейцин, аргинин, гистидин, треонин, метионин, цистин, фенилаланин, тирозин. Из их числа аргинин и гистидин синтезируются частично, в количестве, достаточном для покрытия потребностей взрослого организма, но недостаточном для растущего. Тирозин может быть заменен фенилаланином, а цистин – метионином. Поэтому они являются условно незаменимыми аминокислотами.
Белковые вещества, в состав которых не входит хотя бы одна из числа жизненно необходимых аминокислот или содержат их в крайне незначительном количестве, не могут обеспечить нормальную деятельность организма. Их относят к неполноценным.
Нарушение наиболее благоприятного количественного соотношения незаменимых аминокислот в составе белка уменьшает возможность использования всей белковой смеси на потребности синтеза и этим самым снижает биологическую ценность белка. Поэтому, составляя суждение о питательности белковых продуктов, в том числе мяса и мясных продуктов необходимо исходить прежде всего из того, в какой степени количественное соотношение содержащихся в них аминокислот приближается к оптимальному.
|
|
|
Аминокислотный состав белковых веществ может меняться в зависимости от вида. Пола, возраста и даже физиологического состояния животных перед убоем. Так, в мускулатуре самцов несколько больше аргинина и цистина, в глобулинах самок больше гистидина. В мясе теленка содержится больше гистидина и лизина и меньше аргинина, чем в мясе взрослого быка. По этим причинам аминокислотная характеристика белков мышечной ткани может быть выражена лишь примерными усредненными цифрами.
Соотношение содержания в мышечной ткани незаменимых аминокислот сравнительно близко к оптимальному. Поэтому мышечную ткань продуктивных животных следует рассматривать как основной источник белковых ресурсов питания и как наиболее ценную составную часть мяса.
Что касается неполноценных белков – коллагена и эластина, в составе которых нет триптофана и очень мало метионина, то их биологическая ценность и роль в питании определяется тем, что в некоторых соотношениях с другими белками мышечной ткани они могут компенсировать недостающее количество незаменимых аминокислот из числа тех, которые они содержат в достаточном количестве. Однако их количество в пище должно быть ограниченным, иначе резко нарушается благоприятный баланс аминокислот.
Усвояемость белковых веществ в реальных условиях питания зависит от многих факторов, в том числе от физико-химического состояния белка, его способности перевариваться, т.е. расщепляться пищеварительными ферментами, состава смеси веществ, образующих пищу (в частности содержания в ней жира), присутствия в пище веществ, влияющих на усвоение, например вкусовых и ароматических, способа обработки пищи.
|
|
|
Большинство белков мышечной ткани легко расщепляется пепсином и химотрипсином. Однако усвоение организмом образующихся продуктов расщепления, в том числе и незаменимых аминокислот, их биологическая доступность организму неодинакова и зависит от природы белковых веществ. Так, из незаменимых и условно заменимых аминокислот яичного белка, которые усваиваются более чем на 90 %, триптофан используется на 88,2 %. Из аминокислот белков буженины триптофан, цистин и тирозин используются на 85 – 87 %.
Таким образом, в конечном счёте, питательная ценность белковых веществ определяется степенью или коэффициентом их использования в анаболизме, т.е. в процессах их ассимиляции организмом. По некоторым данным различные виды мяса характеризуются следующим коэффициентом использования в анаболизме: телятина 62 %, говядина 69 %, свинина 74 % (соединительная ткань, содержащаяся в мясе, 25 %). Для покрытия потребностей организма необходимо вдвое меньше животного белка, чем растительного.
Краткая характеристика мышечных белков. Миоген представляет собой комплекс миогенов А, В, и С, отличающихся кристаллической формой. В издании под миогеном подразумевается вся миогеновая фракция. Миоген составляет около 20 % всех белков волокна и является полноценным белком. Он растворяется в воде, образуя 20-30 %-е гомогенные растворы с небольшой вязкостью. Температура денатурации свободного от солей миогена 55-60 0С, изоэлектрическая точка в интервале рН 6,0-6,5. С течением времени часть миогена переходит в нерастворимое состояние.
Моальбумины составляют около 1-2 % белковых веществ мышечного волокна. Растворимы в воде, нерастворимы в кислой среде, так как имеют изоэлектрическую точку около рН 3,0-3,5; температура их денатурации 45-47 0С.
Глобулин Х составляет около 20 % общего количества белковых веществ мышечного волокна. Является полноценным белком. Растворим в солевых растворах даже очень низкой концентрации, температура денатурации при рН 6,5 около 50 0С, при рН 7,0 около 80 0С, изоэлектрическая точка около рН 5,0.
Миоглобин – хромопротеид, составляющий в среднем 0,6-1,0 % общего количества белков. Он состоит из белковой части – глобина и простетической группы – гема. Белковая часть миоглобина отлична от белковой части гемоглобина; гем миоглобина идентичен гему гемоглобина, но на одну молекулу миоглобина приходится одна группа гема. В миоглобине не обнаружено цистина. Миоглобин хорошо растворяется в воде. Температура денатурации миоглобина около 60 0С. Денатурация миоглобина сопровождается отщеплением простетической группы. Миоглобин способен присоединять окись азота, сероводород и кислород за счет дополнительных связей. В последнем случае образуется оксимиоглобин, который переходит с течением времени в метмиоглобин буро-коричневого цвета. При этом железо отдает один электрон. При действии восстановителей метмиоглобин снова образует миоглобин. Эти химические превращения сходны с превращениями гемоглобина.
|
|
|
Миоглобин окрашен в темно-красный цвет и обуславливает естественную окраску мышечной ткани, интенсивность которой зависит от содержания миоглобина. При переходе миоглобина в метмиоглобин окраска мяса становится коричневой; она заметна, когда изменяется более 50 % миоглобина.
Миопротеиды – группа мало изученных сложных белков, имеющих высокую температуру денатурации (около 100 0С). Содержатся в мышечном волокне в незначительном количестве. К группе протеидов относятся также некоторые ферменты мышечного волокна.
Миозин – фибриллярный белок, составляет около 40 % белков волокна. Миозин ультрацентрифугированием разделен на 4 фракции. В издании под миозином подразумевается вся миозиновая фракция. Миозин – полноценный, хорошо переваривающийся белок. Совершенно чистый миозин растворим в воде. При растворении он образует вязкий раствор, содержащий до 4 % белка. Небольшие количества солей щелочных металлов – 0,04-0,25 моль осаждают миозин из его растворов; в солевых растворах повышенной концентрации (до 0,6 моль) он растворяется. Миозин способен взаимодействовать с актином, образуя актомиозин, и с аденозинтрифосфорной кислотой (АТФ), когда он выступает в качестве фермента. При этом образуется аденозиндифосфорная (АДФ) и ортофосфорная кислоты и выделяется энергия, расходуемая на акт мышечного сокращения. Температура денатурации миозина около 45-50 0С (у птицы около 51 0С); изоэлектрическая точка при рН 5,4.
|
|
|
Актин – содержится в количестве около 12-15 %. Актин полноценный белок, переваривается пищеварительными ферментами. Растворим в двухмолярных растворах нейтральных солей при длительном воздействии, осаждается солями кальция. Температура денатурации актина около 50 0С. Под воздействием ионов растворимых солей щелочных и щелочноземельных металлов в определенных концентрациях актин переходит в фибриллярную форму в результате линейной агрегации молекул. По удалении этих солей он снова превращается в глобулярный актин. Фибриллярный актин образуется также при замораживании мышц, вследствие повышения концентрации содержащихся в них солей.
Актомиозин - комплексный белок. При известных условиях миозин SH-группами способен взаимодействовать с оксигруппами фибриллярного актина, образуя актомиозин, который входит в структуру мышечной фибриллы. Такой актомиозин содержит около двух частей миозина и одной части актина. Растворителями извлекается актомиозин, содержащий около 0,25 части актина. В присутствии аденозинтрифосфорной кислоты и в зависимости от её концентрации актомиозин частично или полностью диссоциирует на актин и миозин. Это явление тесно связано с сокращением и посмертным окоченением мышц. В составе мышечной ткани актомиозин в зависимости от условий может находиться в ассоциированной или частью в диссоциированной форме, содержащей неопределенное количество актина. Актомиозин растворим в солевых растворах достаточно высокой концентрации. При этом, чем больше в нем актина, тем выше нужна концентрация соли. При разбавлении актомиозин осаждается. Температура денатурации актомиозина 42-48 0С.
Тропомиозин содержится в волокне в небольшом количестве (около 0,5 %). Он представляет собой фибриллярный белок, по свойствам и аминокислотному составу близок к миозину, но не содержит триптофана. В присутствии нейтральных солей образует вязкие растворы, в которых диспергируется солями на частицы различных размеров. Изоэлектрическая точка при рН 4,6.
Нуклеопротеиды – сложные белки, образованные щелочными белками – гистонами и нуклеиновой кислотой. Составляют небольшую часть белков мышечного волокна. Являются полноценными белками.
Около 6-7 % белков мышечного волокна составляют белки стромы, представленные преимущественно белками типа коллагена и эластина.
Большинство белковых веществ мышечного волокна обладает свойствами ферментов. В состав мышечного волокна входят представители всех групп ферментов: ферменты расщепления с участием воды и ортофосфорной кислоты (гидролазы и фосфорилазы), окислительно-восстановительные ферменты (переносчики электронов), десмолазы, катализирующие расщепление связи между атомами углерода, феразы, катализирующие перенос групп атомов между различными соединениями, изомеразы, катализирующие внутримолекулярные процессы. Поэтому в мышечном волокне возможны любые самые разнообразные ферментативные превращения. Однако после прекращения жизни животного в связи с отсутствием поступления кислорода в клетки на первый план выступает разрушительная деятельность ферментов, преимущественно гидролаз и фосфорилаз, которая приводит к существенным изменениям белковой, липидной и углеводной фракций и многих экстрактивных веществ.
Липиды мышечной ткани. В зависимости от вида и упитанности животных мышечная ткань содержит различное количество липидов. Часть этих липидов, главным образом глицеридов, находится в тончайших прослойках соединительной ткани и легко извлекается органическими растворителями. Другие липиды входят в состав волокна, в том числе как липидные компоненты белковых веществ, и неполностью извлекаются растворителями.
Около 0,20-0,25 % липидов приходится на долю фосфатидов, преимущественно лецитина. В небольшом количестве в мышцах обнаружены стериды и холестерин (50-60 мг % к массе мышц). Часть липидов мышечного волокна и холестерина наряду с белками органически входят в его структуру; другая часть представляет собой промежуточные продукты обмена веществ.
Полиненасыщенные жирные кислоты, фосфолипиды и холестерин - необходимые компоненты пищи. По данным Института питания АМН, суточная потребность в полиненасыщенных кислотах в среднем составляет 3-6 г, в фосфолипидах – 5 г, в холестерина – 0,3-0,6 г.
Прочие органические вещества. Большинство этих веществ извлекается (экстрагируется) при обработке мяса водой. Их поэтому обычно называют экстрактивными веществами. Многие из них претерпевают глубокие химические изменения с момента прекращения жизненных процессов в тканях, образуя другие вещества. Поэтому состав этой фракции мышечной ткани качественно и количественно непостоянен, в связи с чем изменяются и некоторые важные свойства мяса.
Прочие органические вещества мышечной ткани соответственно особенностям их состава и значению можно разделить на три группы: азотистые, безазотистые, витамины. В свою очередь азотистые небелковые вещества разделяются на азотистые основания, аминокислоты и прочие азотистые вещества.
Азотистые основания представлены основаниями группы карнозина (карнозин, ансерин), основаниями группы креатина (креатин, креатинин, метилгуанидин), основаниями группы холина (холин, карнитин, бетаин) и пуриновыми и пиримидиновыми основаниями (аденин, гуанин, гипоксантин).
Общее содержание свободных аминокислот в мышечной ткани незначительно и не превышает 0,7% к её массе. Их состав непостоянен и меняется с течением времени после прекращения жизни животного.
Из прочих азотистых небелковых веществ наиболее важными являются креатинфосфорная (КРФ), аденозинтрифосфорная (АТФ), аденозиндифосфорная (АДФ), аденозинмонофосфорная, или адениловая (АМФ), инозиновая кислоты, глютатион, глютамин, мочевина, аммонийные соли.
Несмотря на сравнительно небольшое относительное содержание азотистых экстрактивных веществ, их роль в питании значительна, так как они включают вкусовые, ароматические и биологически активные вещества. Сырое мясо обладает слабым кисловатым вкусом и запахом. Специфический аромат и вкус, присущие каждому виду мяса, появляются лишь после тепловой обработки, таким образом, в сыром мясе содержатся компоненты, которые, видоизменяясь при нагреве, образуют ароматические и вкусовые вещества.
Можно полагать, что специфичность запаха вареного мяса связана с составом липидной фракции мышечной ткани, так как запах различных видов обезжиренного мяса мало отличается.
Вопрос о том, какие именно вещества придают мясу его специфические аромат и вкус после тепловой обработки, еще до конца не решен. Однако экспериментально доказана связь вкуса мяса с содержанием в нем свободной глютаминовой кислоты и свободных пуринов, в частности гипоксантина. Количество этих веществ в мышечной ткани различно и зависит от глубины развития посмертных изменений в тканях, в частности от степени распада амида глютаминовой кислоты – глютамина и аденозинтрифосфорной кислоты. Запахом бульона обладает также кетомасляная кислота.
В числе экстрактивных веществ находятся раздражители секреции желудочных желез. Как установлено И.П. Павловым, без них мясо остается в желудке долгое время, практически не перевариваясь. Мясной экстракт (или навар) он относит к лучшим возбудителям желудочного сока. Эти свойства мясного экстракта обусловлены содержащимися в мышцах некоторыми азотистыми основаниями (метилгуанидином, карнозином, карнитином).
В число важнейших безазотистых органических компонентов мышечной ткани входят гликоген и продукты его фосфоролиза (гексозофосфорные эфиры, молочная кислота) и амилолиза (декстрины, мальтоза, глюкоза). Их количество зависит от физиологического состояния животных перед убоем и от глубины развития автолитических процессов после убоя, в ходе которых гликоген расщепляется до низкомолекулярных соединений.
Часть гликогена мышечного волокна связана с белками (миозином, миогеном), другая находится в свободном состоянии. Количество гликогена в парном мясе в среднем составляет 450-900 мг %, но может превышать 1 %. В мышцах плохо откормленных, истощенных и больных животных его в 2-3 раза меньше, чем в мышцах откормленных животных, находящихся в нормальном физиологическом состоянии. В разных мышцах содержание гликогена различно: в усиленно работающих мышцах его почти в 1,5 раза больше, чем в мышцах мало работающих.
Соответственно количеству гликогена изменяется и содержание в мышцах продуктов его распада, в том числе и молочной кислоты. Её количество колеблется в пределах 150-700 мг % и наряду с некоторыми другими кислотами (фосфорной, пировиноградной, янтарной) определяют величину рН мышечной ткани. Количество моносахаридов в пересчете на глюкозу колеблется в пределах 0,09-0,6 мг %.
В составе мышечной ткани имеются почти все водорастворимые витамины: В1 (тиамин), В2 (рибофлавин), В6 (пиридоксин), РР (никотинамид), В3 (пантотеновая кислота), В12, биотин (витамин Н), фолиевая кислота. Для различных видов животных и разного их состояния количество витаминов не одинаково.
К витаминам относится также холин, содержащийся в мышцах в количестве 80-100 мг %. В липидной части мышц содержится некоторое (около 0,02 мг%) количество витамина А.
Минеральные вещества. В составе мышечной ткани найдены металлы: калий, натрий, кальций, магний, железо, цинк. Эти металлы частью связаны с белковыми коллоидами мышечного волокна, заряженными в большинстве отрицательно, частью с неорганическими анионами пиро - и ортофосфорной, серной, соляной, угольной кислот, с которыми образуют электролиты. В белках мышц больше катионов, чем анионов, в мышечной жидкости, наоборот. Некоторые из электролитов (соли угольной, фосфорной кислот) играют роль буферных систем мышечного волокна. Железо входит в состав миоглобина. Количество минеральных фосфорных соединений изменяется в связи с распадом орга-
нических фосфорсодержащих составных частей мышечной ткани. В мышцах в незначительном количестве (порядка 0,06-0,08 мг %) содержатся микроэлементы: медь, марганец, никель, кобальт и другие, являющиеся компонентами ферментных систем.
Соединительная ткань. Основу соединительной ткани составляют коллагеновые и эластиновые волокна. Коллагеновые волокна - преимущественно лентовидной формы, но известно до пяти морфологических вариантов; эластиновые волокна - нитевидной формы. Коллагеновые и эластиновые волокна вместе с перепонками образуют губчатую структуру соединительной ткани, в ячейках которой содержится тканевая жидкость. Клеточные элементы в соединительной ткани немногочисленны, хотя и разнообразны (рис. 2.2).
Высокая прочность коллагеновых и упругость эластиновых волокон обуславливают прочностные свойства соединительной ткани в целом, которые значительно превосходят такие же свойства мышечной ткани. Если сопротивление резанию различных мускулов колеблется в пределах 1,3-8,6 кн /м, то для соединительной ткани оно составляет 27-40 кн / м.
Химический состав соединительной ткани различен и зависит главным образом от соотношения в ней количества коллагеновых и эластиновых волокон. В некоторых видах соединительной ткани (рыхлая соединительная ткань, сухожилия) преобладает коллаген и в таких тканях несколько больше воды. Другие виды соединительной ткани содержат больше эластина и беднее водой. Так, в состав сухожилий входит до 32 % коллагена и лишь 0,7 % эластина, а в состав выйной связки – до 32 % эластина и лишь 1,6 % коллагена.
В соединительной ткани любого вида большую часть сухого остатка составляют коллаген и эластин, но количественное соотношение их различно. Свойства, пищевая ценность и промышленное значение соединительной ткани определяется свойствами коллагена и эластина и их количественным соотношением.
В зависимости от анатомического происхождения соединительной ткани различают коллаген волокнистый (сухожилия и кожа), гиалиновый (кость), хондриновый (хрящи). Аминокислотный состав коллагенов разного происхождения несколько отличается, но во всех случаях в коллагене очень мало метионина и отсутствует триптофан.
Нативный коллаген нерастворим в воде, но набухает в ней. Он медленно переваривается пепсином и почти не переваривается трипсином и панкреатическим соком, но расщепляется коллагеназой на цепочки параллельно оси волок-
на. При нагреве коллагена до 60-70 0С и тщательной механической деструкции переваривающее действие пепсина усиливается. Таким образом, коллаген, хотя и сравнительно медленно, все же может усваиваться организмом. Однако поскольку он относится к неполноценным белкам, употребление в пищу продуктов с большим содержанием коллагена обуславливает отрицательный баланс азота: организм выделяет его больше, чем получает с пищей. В умеренных количествах коллаген сберегает в пище полноценные белки.

Рис. 2.2. Соединительная ткань:
1 – коллагеновые волокна, 2 – эластиновые волокна, 3 – клетки
При нагреве коллагена выше 65 0С полностью разрываются водородные и солевые связи, удерживающие полипептидные цепочки в структуре коллагена, без заметного нарушения связей внутри цепей. Этот процесс, протекающий с участием воды, известен под названием пептизации коллагена. Продукт пептизации, состоящий из нескольких, связанных друг с другом полипептидных цепочек, называется глютином.
Практически одновременно с образованием глютина происходит гидролитический распад части полипептидных цепочек на более мелкие звенья. В совокупности образующие полидисперсный продукт гидролиза глютина – смесь желатоз (глютоз).
Эластин не содержит триптофана и в нем очень мало метионина и гистидина. Он почти не переваривается пепсином, медленно трипсином и сравнительно легко эластазой. Он очень устойчив к действию химических реагентов, не изменяется в растворах кислот и щелочей, выдерживает длительный нагрев при 125 0С. Следовательно, эластин практически не имеет какой-либо пищевой ценности.
Пищевая и промышленная ценность соединительной ткани. Благодаря способности коллагена переходить в глютин разновидности соединительной ткани, богатые им, могут быть использованы для производства некоторых видов пищевой и технической продукции, в том числе желатина и клея. Ткани, которые содержат много эластина, пригодны для производства кормовой продукции.
Соединительная ткань, связанная с мышечной и органически входящая в состав мяса (внутримышечная), уменьшает его пищевую ценность. Она снижает качество мяса также и потому, что увеличивает его жесткость в зависимости от соотношения в ней количества коллагеновых и эластиновых волокон, строения и толщины коллагеновых волокон и пучков.
Данные о содержании коллагена в некоторых мышцах и характеристика их жесткости после варки в течение 60 минут при 105 0С приведены в табл. 2.4.
Жировая ткань представляет собой разновидность рыхлой соединительной ткани, клетки которой содержат значительное количество нейтрального жира. В соединительной ткани они располагаются в одиночку или небольшими группами, в жировой – скапливаются в большие массы. Размеры жировых клеток достигают 120 мкм. Они обладают обычными для клеток структурными элементами, но в них центральная часть заполнена жировой каплей, а протоплазма и ядро оттеснены к периферии (рис. 2.3.). Жировые «капли» представляют собой сложную дисперсную систему, образованную жиром и обводненной фазой. Наряду с жирами в составе жировой ткани содержатся различные липоиды (преимущественно фосфатиды). Но количество их невелико и не превышает долей процента.
Соответственно распределению соединительной ткани в мясе различают внутримышечную, межмышечную и поверхностную жировую ткань. В мясе упитанных животных (крупного рогатого скота и свиней) жировая ткань как бы прослаивает мышечную, образуя на разрезе так называемую мраморность.
Пищевая ценность жировой ткани определяется свойствами содержащихся в ней жиров и пищевой ценностью липоидов. Белковая часть не имеет существенного пищевого значения.
Энергетическая ценность жиров обусловлена, тем, что они являются носителями больших запасов энергии. Калорийность жиров превышает калорийность белков и углеводов и достигает 39 кДж на 1 г жира. В этом отношении животные жиры независимо от содержания в их составе радикалов насыщенных и ненасыщенных кислот масло отличаются друг от друга.
Биологическая ценность жиров зависит от содержания в них радикалов полиненасыщенных жирных кислот с двумя и более двойными связями, разделенными метиленовым звеном, с числом углеродных атомов 18 и более. Эти кислоты не синтезируются организмом в необходимых количествах. К ним относятся линолевая (две двойные связи), линоленовая (три двойные связи), арахидоновая (четыре двойные связи).
В жирах в определенных количествах содержатся такие витамины, как А, D, Е, К.
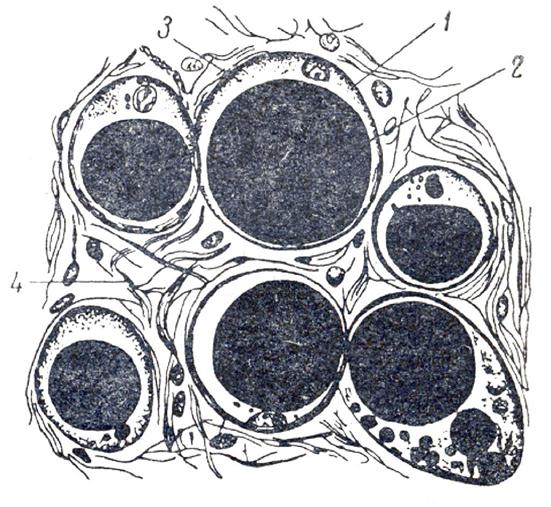
Рис. 2.3. Жировая ткань:
1 – жировая клетка, 2 – жировая капля, 3 – протоплазма, 4 – волокна
соединительной ткани
В процессе усвоения пищи около 20-25 % жира гидролизуется под действием панкреатического сока. Остальной жир всасывается стенками кишечника в нейтральном состоянии. И расщепление жира, и его всасывание требует эмульгирование его в водной среде до размеров частиц менее 0,5 мкм с отрицательным зарядом. Поэтому усвояемость жиров зависит от их способности образовывать эмульсии в водной среде, что в свою очередь связано с их температурой плавления. Жиры с температурой плавления ниже температуры тела хорошо усваиваются, так как, попадая в организм, они целиком переходят в жидкое состояние и легко эмульгируются.
Костная ткань. Костная ткань сильно отличается развитым межклеточным (основным) веществом, состоящим из органической части и воды. В основном веществе расположены костные клетки и проходят кровеносные сосуды. В кости различают наружный слой, и внутренний, менее плотный, состоящий из губчатого вещества.
В костях сложного профиля и кулачках трубчатой кости плотный слой незначителен. В плоских костях он намного толще и иногда превосходит губчатый слой. Трубка трубчатой кости целиком состоит из плотного вещества. Плотное и губчатое вещества построены из окостеневших пластинок, образованных небольшими пучками коллагеновых фибрилл. В губчатом веществе пластины расположены менее упорядоченно и образуют многочисленные мельчайшие поры, в которых находится красный костный мозг. Снаружи кость покрыта соединительно тканой оболочкой – надкостницей, а поверхность кулачков – хрящевым слоем (рис.2.4).
Главный органический элемент основного вещества кости – коллаген (оссеин), составляющий 24-34 % к массе сухой обезжиренной кости. Основное вещество содержит 30-65 % минеральных составных частей. Около 70 % минеральных веществ приходится на фосфорнокислый кальций и около 10 % на углекислый кальций.
В связи с особенностями строения и состава различных костей, характером использования и особенностями технологической обработки их подразделяют на три группы: трубчатые кости (бедренная, берцовая, плечевая, предплечье, пястная, плюсневая); паспортная кость (плоские кости) и рядовая кость (кости сложного профиля и кулачки трубчатой кости).
Диафиз обладает высокой прочностью, его модуль упругости около 156 Мн/м2. Поэтому его после выварки жира используют как поделочный материал. Для сохранения необходимых свойств трубки вываривать жир следует осторожно и отдельно от эпифизов.
Кулачки, или эпифизы, образованы в основном губчатой тканью и лишь на поверхности состоят из плотной ткани. Мельчайшие полоски губчатой ткани заполнены красным костным мозгом (жировыми клетками), содержащим около 92 % липидов, в составе которых около 99,5 % жира, 0,21% фосфатидов, 0,28 % холестерина.
Паспортная кость состоит главным образом из плотной ткани. Внутри имеется небольшой слой губчатой ткани. Плотная ткань богата коллагеном (около 93 % к общему количеству белков) и поэтому является хорошим сырьем для производства желатина. К паспортной кости относятся плоские кости скелета: кости черепа, челюсти, кости таза, лопатки, опиленные ребра, а также отходы трубчатой кости.
Рядовая кость построена сходно с эпифизами; это кости сложной конфигурации: позвонки, запястья, предплюсны, путовый состав и пальцы, носовые раковины черепа.
Состав кости заметно меняется с изменением упитанности скота: с повышением упитанности несколько повышается содержание жира и минеральных веществ и уменьшается содержание воды. В позвонках это же наблюдается в направлении от головы к задней части туши. В головке ребер больше жира и воды и меньше минеральных веществ, чем в их теле. Трубчатые кости задних конечностей содержат несколько больше жира и коллагена, чем трубчатые кости передних конечностей.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1117; Нарушение авторских прав?; Мы поможем в написании вашей работы!