
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначте, скільки енергетичних рівнів мають атоми елементів Кальцію, Титану, Гафнію?
|
|
|
|
Прометій Pm – представник родини f – елементів (мал.5). Електронна формула f-елемента Прометію Pm: 1s22s22р63s23p64s22d104p65s24d105p66s24f 5.
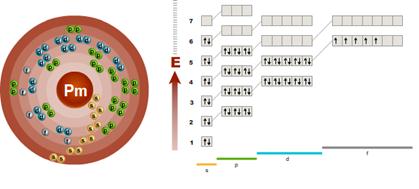 Енергетичні рівні(Е)
Енергетичні рівні(Е)
Орбіталі(s-, p-, d-, f-)
Мал. 5. Електронна будова атому Прометію
Для хімічних елементів характерні певні фізико-хімічні параметри, що пояснюють фізико-хімічні властивості та біологічну роль.
Заряд ядра – найважливіша характеристика елемента. Він визначає порядковий номер елемента в періодичній системі та число електронів, які розміщуються на енергетичних рівнях атома.
Радіус атома. У періодах із зростанням зарядів ядер атомів елементів притягання ядром електронної оболонки посилюється — відбувається своєрідне їх «стискання» і радіус атомів та йонів зменшується. Така тенденція характерна для s- та р- елементів. Наприклад, у разі переходу від Літію до Неону заряд ядра поступово збільшується (від +3 до +10), що зумовлює зростання сил притягання електронів до ядра. Розміри атомів при цьому зменшуються. Тому на початку періодів розміщуються елементи, в яких на зовнішньому енергетичному рівні невелике число валентних електронів і великий радіус атома. У групах навпаки: зі збільшенням кількості енергетичних рівнів радіус атома збільшується, причому в підгрупах s- і р- елементів збільшення радіусу помітніше, ніж у підгрупах d- елементів. У періодах із зростанням зарядів ядер атомів радіус атомів елементів зменшується, а в групах (головних підгрупах) — збільшується. Зрозуміло, чим більший радіус атома, тим далі від ядра перебувають валентні електрони і тим слабше вони зв'язані з ядром, отже, легше від нього відриваються. Така структура атома характерна для металічних елементів.
|
|
|
Енергія йонізації (Ейон) – це мінімальна енергія, необхідна для відщеплення електрона від не збудженого атома і перетворення його на катіон:
Е0 → Е+ + 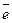
де Е0 – хімічний елемент, Е+ – катіон цього елемента, 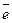 – електрон. Енергія йонізації вимірюється в одиницях енергії Дж/моль або в електрон-вольтах (еВ/атом). Енергія йонізації є однією з головних характеристик атома, від якої значною мірою залежать природа і міцність утворених атомом хімічних зв'язків. Енергія йонізації залежить від заряду ядра, відстані між ядром і зовнішнім електроном та електронної конфігурації атома, тобто від положення елемента у періодичній системі, і змінюється як у межах груп, так і в межах періодів.
– електрон. Енергія йонізації вимірюється в одиницях енергії Дж/моль або в електрон-вольтах (еВ/атом). Енергія йонізації є однією з головних характеристик атома, від якої значною мірою залежать природа і міцність утворених атомом хімічних зв'язків. Енергія йонізації залежить від заряду ядра, відстані між ядром і зовнішнім електроном та електронної конфігурації атома, тобто від положення елемента у періодичній системі, і змінюється як у межах груп, так і в межах періодів.
Електронегативність – це здатність атома елемента в хімічній сполуці притягувати до себе електрони. У періодах у міру зростання зарядів ядер атомів число валентних електронів збільшується, радіус атомів зменшується, а спорідненість до електрону зростає. Отже, електронегативність збільшується.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3623; Нарушение авторских прав?; Мы поможем в написании вашей работы!