
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Чим можна пояснити схожість властивостей елементів ІА групи?
Загальні хімічні властивості s - елементів
У періодичній системі хімічних елементів Д.І. Менделєєва до біогенних s- елементів входять елементи І групи головної підгрупи (далі ІА групи) (Li, Na, K, Rb, Cs, Fr) та ІІ групи головної підгрупи (далі ІІА групи) (Be, Мg, Ca, Sr, Ba, Ra), а також Гідроген (Н). Загальними властивостями для вказаних елементів є заповнення в їх атомах s- підрівня зовнішнього енергетичного рівня. Електронна формула зовнішньої оболонки елементів ІА групи та елементу Гідрогену – ns1, а елементів ІІА групи – ns2. Ступінь окиснення атомів s- елементів, як і валентність, є постійною і дорівнює +1 для елементів І групи, і +2 для елементів ІІ групи. Атоми s- елементів легко віддають свої валентні електрони і перетворюються на позитивно зарядження йони. Елементи, що розміщуються на початку зазначених періодів володіють металічними властивостями.
До ІА групи періодичної системи елементів Д.І.Менделєєва відносять елементи – Літій Li, Натрій Na, Рубідій Ru, Цезій Cs, Францій Fr, які відіграють значну біологічну роль в організмі людини. Їх висока концентрація в організмі пов’язана з утворенням сполук, що легко розчиняються в біологічних рідинах. Для живих організмів найбільшого значення набувають Гідроген, Калій і Натрій. Всі елементи ІА групи досить схожі за властивостями.
Однак, хімічні властивості елементів Калію, Рубідію та Цезію відрізняються від властивостей Натрію та Літію, що можна пояснити різницею в розмірах атомів та значеннями потенціалів йонізації. Внаслідок цього в живому організмі Літій може заміщувати Натрій (явище антагонізму), і навпаки. Антагонізм йонів - це здатність йонів з однаковими електричними зарядами, що знаходяться в розчині, взаємно пригнічувати характерні кожному з них хімічні властивості. У цілому ряді випадків додавання одного йону пригнічує надходження іншого. На цьому принципі ґрунтується введення натрій хлориду при отруєнні солями Літію. У відповідності з принципом Ле-Шательє рівновага між йонами Натрію та Літію в організмі зміщується в напрямку виведення йонів Li+, що призводить до зниження його концентрації в організмі людини та досягненню лікувального ефекту. Різниця в хімічних властивостях елементів ІА групи визначає різні біологічні функції цих елементів в живому організмі. Так, йони Na+ і Li+ входять до складу зовнішньо клітинної рідини, а йони K+ розміщуються у внутрішньоклітинній рідині. Йони Натрію необхідні для скорочення серцевих м’язів, а йони Калію впливають на їх розслаблення між скороченнями. Атоми Натрію та Калію, як правило, є антагоністами, але в багатьох випадках схожість фізико-хімічних властивостей обумовлює їх взаємозаміщення в живих організмах.
Атом Гідрогену, у порівнянні з атомами інших елементів має найпростішу електронну структуру 1s1. Функції його в організмі людини ближчі до функцій йонів лужних металів, ніж галогенів. В організмі людини він входить до складу сполук, що також містять Карбон, Нітроген, Сульфур тощо. Незначна частина Гідрогену перебуває у вигляді йону гідроксонію Н3О+, який відіграє важливу роль у підтримці кислотно-лужної рівноваги організму для перебігу біохімічних реакцій. Йони гідроксонію, здебільшого, пригнічують діяльність мікроорганізмів, що потрапляють до шлунку та беруть участь у гідролітичних реакціях як каталізатори. Також указані йони відіграють значущу роль у стабілізації надмолекулярних структур білків і нуклеїнових кислот.
Лужні метали досить активні в хімічному відношенні елементи. Хімічна активність підвищується закономірно зі збільшенням радіуса атомів. Лужні метали є сильними відновниками. Це спостерігається при їх взаємодії з неметалами – киснем, фосфором, азотом, галогенами та ін.
Наприклад,
 2Na + Cl2 = 2NaCl
2Na + Cl2 = 2NaCl
Na0 – 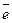 → Na+ 2 Відновник
→ Na+ 2 Відновник
Cl02 + 2 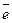 → 2Cl- 1 Окисник
→ 2Cl- 1 Окисник
Са + Br2 = CaBr2
 Ca0 – 2
Ca0 – 2 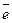 → Ca2+ 1 Відновник
→ Ca2+ 1 Відновник
Br02 + 2 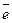 → 2Br- 1 Окисник
→ 2Br- 1 Окисник
Внаслідок цих реакцій утворюються йонні сполуки, які, в переважній більшості, добре розчинні у воді.
До ІІА групи періодичної системи елементів Д.І.Менделєєва входять Берілій Be, Магний Mg, Кальцій Ca, Стронцій Sr, Барій Ba та Радій Ra які відіграють велике значення в життєдіяльності організмів. Важливими для організму людини є такі макроелементи, як Магній і Кальцій. Магній входить до складу багатьох ферментативних систем, а Кальцій – є головним компонентом кісткової тканини. Мікроелемент Стронцій впливає на процеси розвитку кісткової тканини, а Барій відіграє значущу роль у функціонуванні органів зору. В живих організмах ступінь окиснення для вказаних елементів та їх сполук становить +2.
Атоми елементів ІІ А групи утворюють активні метали, які володіють відновними властивостями. В зв’язку зі збільшенням атомних радіусів і зменшенням потенціалу йонізації в групах в направленні зверху вниз, відновні властивості цих елементів збільшується в тому ж напрямку.
Не дивлячись на те, що число валентних електронів у атомів s-елементів ІІА групи однакове, властивості Магнію та Берилію суттєво відрізняються від властивостей інших лужноземельних металів.
|
|
Дата добавления: 2014-11-25; Просмотров: 2569; Нарушение авторских прав?; Мы поможем в написании вашей работы!