
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зазначте ступені окиснення елементів в зазначених сполуках
Склад і будова комплексних сполук. Координаційна теорія А.Вернера
КОМПЛЕКСНІ СПОЛУКИ
Усвідомлення змісту цього параграфу дає змогу:
- описувати будову комплексних сполук;
- класифікувати комплексні сполуки;
- складати назву комплексних сполук;
- розрізняти ізомери комплексних сполук;
- визначати хімічні властивості комплексних сполук
- застосовувати знання про комплексні сполуки для пояснення їх біологічної ролі та застосуванні в медицині.
Атоми елементів, що проявляють біогенні властивості, містяться в організмі людини не тільки в йонному стані, а також у формі комплексних сполук. До біогенних елементів відносять наступні s-елементи: Na, K, Ca Mg та d-елементи: Mn, Fe, Co, Cu, Zn, Mo. Йони лужних металів беруть участь у створенні електролітного середовища організму, визначають процеси всмоктування речовин в органах і тканинах. Так, йони Са2+ утворюють малорозчинні сполуки, служать основою скелету та хрящів. При цьому вказані біометали є центром близько 30% усіх ферментативних систем організму. Йони металів, що легко гідролізують, беруть участь в реакціях ферментативного гідролізу; йони металів, що проявляють змінну валентність регулюють окисно-відновні процеси.
Особливе місце серед неорганічних сполук посідають так звані комплексні, або координаційні сполуки. До цього класу належить багато природних сполук, наприклад, хлорофіл та гемоглобін, які забезпечують життєдіяльність рослин та живих організмів. Комплексні сполуки та реакції комплексоутворення мають широке застосування в аналітичній хімії, в методах якісного і кількісного аналізу, в медичній та фармацевтичній практиці, перш за все, завдяки властивостями комплексних сполук: стійкість, інтенсивність забарвлення, незначна розчинність.
Комплексними сполукаминазиваються хімічні сполуки, кристали яких складаються з комплексних груп, утворених внаслідок взаємодії йонів або молекул, здатних самостійно існувати в розчині. Комплексні сполуки виділені в окремий клас речовин за певними ознаками, а саме: багатокомпонентність складу; здатність складових частин до самостійного існування; здатність дисоціювати на складові частини за гетеролітичним механізмом; наявність стійкої просторової структури, утвореної за донорно-акцепторним механізмом. Наприклад:
CuSO4 + 4NH3→[Cu(NH3)4]SO4
HgІ2 + 2KІ → K2[HgІ4]
Вперше комплексні сполуки були одержані у середині XVIII ст. і встановлено, що окрім основних валентних зв’язків, характерних для елементів, існують додаткові взаємодії, які неможна пояснити на основі класичного вчення про валентність. Утворення комплексів можна представити як результат взаємодії за донорно-акцепторним механізмом стабільних при звичайних умовах частинок: атомів, йонів або молекул. Будову і властивості комплексних сполук пояснює координаційна теорія, яку розробив швейцарський хімік А.Вернер (1893 р.), суть якої полягає в наступному:
1) окрім головних валентностей, у атомів існують додаткові побічні валентності;
2) насичення основних валентностей лежить в основі утворення сполук першого порядку, наприклад, найпростіших бінарних сполук типу HCl, H2O, NH3, CuCl2 тощо;
3) насичення побічних валентностей лежить в основі утворення сполук вищого порядку, які є продуктами сполучення сполук першого порядку, наприклад, NH4Cl, Fe(CN)2×4KCN, AlCl2×6H2O і т.д.
Згідно сучасних уявлень в молекулах комплексних сполук розрізняють:
1. Внутрішню координаційну сферу, що утворена центральним атомом (комплексоутворювачем), навколо якого знаходяться ліганди ( або адденти) – молекули або йони, наприклад H2O, NH3, Cl–, Fe–, I–, CN– та ін. Комплексоутворювачем у переважній більшості є йон Меn+. Внутрішня координаційна сфера може бути електронейтральною або у формі катіону чи аніону;
2. Зовнішню координаційну сферу утворює сукупність всіх йонів, які не зв’язані з центральним атомом знаходяться за межами внутрішньої координаційної сфери (мал.7).
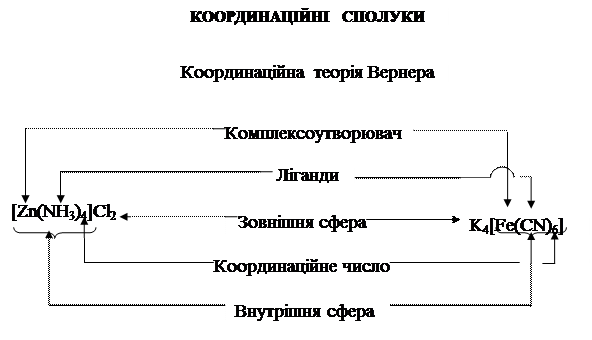 |
Мал. 7. Будова координаційних сполук
Відомі комплексні сполуки, які складаються тільки з центрального атому – комплексоутворювача і оточуючих його лігандів, що не мають зовнішньої координаційної сфери. Наприклад, нікол карбоніли [Ni(CO)4] та ферум карбоніли [Fe(CO)5], дихлордиамінплатина [Pt(NH3)2 Cl2] тощо. Найбільш стійкі комплекси утворюють d-елементи. Для життєдіяльності людини особливо важливими є комплексні сполуки Mn, Fe, Co, Cu, Zn, Mo. Амфотерні р-елементи Al, Sn, Pb також утворюють різні комплекси. Біогенні s-елементи Na, K, Ca, Mg можуть утворювати нестійкі комплекси. Таким чином, здатність до комплексоутворення визначається хімічними властивостями елементів. У періодичній системі ця здатність зменшується приблизно в наступному порядку: f > d > p >> s. В якості лігандів у комплексних сполуках фігурує гідроксильна група ОН– та оксогрупа О2–, аніони кислот, а також полярні молекули різних неорганічних і органічних сполук (H2O, NH3, CO, NO, C3H5N) та ін. Заряд комплексного йону (або нейтрального комплексу) представляє суму зарядів центрального атому (його ступеню окиснення) і зарядів лігандів. Йони зовнішньої сфери більш рухливі і легше вступають в обмінні реакції, ніж йони внутрішньої сфери. Комплексоутворювач характеризується координаційним числом, яке показує кількість лігандів, що координується навколо центрального атому. Це кількість хімічних зв’язків, за допомогою яких ліганди сполучаються з комплексоутворювачем. Зі збільшенням ступеню окиснення центрального атому, збільшується і значення координаційного числа, яке, переважно, в два рази більше від валентності комплексоутворювача і, в більшості випадків, приймає значення від 1 до 12, найчастіше 2, 4, 6 (табл.7). Деякі ліганди приєднуються до центрального атому декількома координаційними зв’язками, при цьому, займаючи два і більше число місць. У такому випадку ліганд має координаційну ємність, або дентатність, що визначається кількістю місць, які займає ліганд у внутрішній координаційній сфері комплексу.
Таблиця 7
|
|
Дата добавления: 2014-11-25; Просмотров: 1580; Нарушение авторских прав?; Мы поможем в написании вашей работы!