
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина 2 страница
|
|
|
|
Завдання 4. Характерні реакції аніонів третьої
аналітичної групи
Реакції виявлення аніонів третьої аналітичної групи
(NO3-, NO2-, CH3COO-)
4.1. Реакції нітрат-йонів
4.1.1. Дія солей феруму (II)
Нітрат-йони з йонами Fe2+ в присутності концентрованої сульфатної кислоти утворюють коричневе кільце [Fe(NO)]SO4:
2NaNO3 + 6FeSO4 + 4H2SO4 → Na2SO4 + 3Fe2(SO4)3 + 2NO + 4H2O
Нітрогену оксид з надлишком реактиву утворює нестійкі комплексні йони FeNO2+ бурого кольору:
NO + FeSO4 → [Fe(NO)]SO4
Виконання досліду:
До 3-5 крапель натрію нітрату додають 5-8 крапель насиченого розчину ферум (II) сульфату, перемішують та обережно по стінці пробірки додають 2-3 краплі концентрованої сульфатної кислоти. У місці стикання рідин утворюється темно-буре кільце.
4.1.2. Дія розчину дифеніламіну (фармакопейна)
Нітрат-йони оксидують дифеніламін, при цьому утворюється сполука темно-синього кольору:

Виконання досліду:
На годинникове скло поміщають 3-4 краплі розчину дифеніламіну в концентрованій сульфатній кислоті і додають краплю розчину калію нітрату. Розчин забарвлюється в темно-синій колір.
4.1.3. Дія металічної міді
Мідь в присутності сульфатної кислоти відновлює нітрат-йони до нітрогену (II) оксиду:
3Cu + 8NaNO3 + 4H2SO4 → 4Na2SO4 + 3Cu(NO3)2 + 2NO + 4H2O
Виконання досліду:
До 4-5 крапель розчину натрію нітрату додають 5-6 крапель концентрованої сульфатної кислоти, кусочок металічної міді і нагрівають на водяній ванні. Нітрогену (II) оксид, що виділяється, оксидується киснем повітря до NO2, який має буре забарвлення, що добре видно на білому фоні.
4.2. Реакції нітрит-йонів
4.2.1. Дія сильних кислот (фармакопейна)
Нітрит-йони при дії сильних кислот утворюють нестійку нітритну кислоту, яка розкладається на нітрогену (II) оксид, нітрогену (IV) оксид і воду:
|
|
|
2KNO2 + H2SO4 → K2SO4 + NO2 + NO + H2O
Виконання досліду:
До 3-5 крапель розчину калію нітриту додають 3-5 крапель розчину концентрованої сульфатної кислоти. Нітрогену (IV) оксид, який виділяється, добре видно на білому фоні.
4.2.2. Дія розчину антипірину (фармакопейна)
Нітрит-йони реагують з антипірином в кислому середовищі з утворенням нітрозоантипірину смарагдово-зеленого кольору:

Виконання досліду:
У фарфоровій чашці розчиняють декілька кристалів антипірину в 2-3 краплях розведеної хлоридної кислоти та додають 2-3 краплі розчину натрію нітриту.
4.2.3. Дія розчину калію перманганату
Нітрит-йони у кислому середовищі знебарвлюють розчин калію перманганату (на відміну від нітрат-йонів):
5KNO2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 +
5KNO3 + 3H2O
Виконання досліду:
До 4-5 крапель розведеного розчину калію перманганату, підкисленого 4-5 краплями 1М розчину сульфатної кислоти, додають при струшуванні 5-7 крапель розчину калію нітриту і спостерігають обезбарвлення розчину.
4.2.4. Дія розчину дифеніламіну (фармакопейна)
Нітрит-йони взаємодіють з дифеніламіном, при цьому утворюється сполука синього кольору.
Виконання досліду:
На годинникове скло поміщають 3-4 краплі розчину дифеніламіну в концентрованій сульфатній кислоті і додають краплю розчину калію нітриту. Розчин забарвлюється в синій колір.
4.3. Реакції ацетат-йонів
4.3.1. Дія мінеральних кислот
Ацетат-йони при дії мінеральних кислот утворюють ацетатну кислоту, яку виявляють за характерним запахом:
2СH3COONa + H2SO4 → Na2SO4 + 2СH3COOH
Виконання досліду:
До 3-5 крапель розчину натрію ацетату додають 3-5 крапель 1М розчину сульфатної кислоти і обережно нагрівають.
4.3.2. Дія етилового спирту (фармакопейна)
Ацетат-йони у присутності концентрованої сульфатної кислоти і етилового спирту при нагріванні утворюють етилацетат з характерним запахом:
|
|
|
СH3COOH + C2H5OH → СH3COOC2H5 + H2O
Виконання досліду:
У пробірці змішують декілька кристалів натрію ацетату з 3-5 краплями концентрованої сульфатної кислоти і 5-8 краплями етилового спирту. Суміш обережно нагрівають на водяній ванні протягом 2 хвилин, після чого виливають у склянку з холодною водою і досліджують запах.
4.3.3. Дія ферум (III) хлориду
Ацетат-йони з розчином ферум (III) хлориду утворюють червоно-буре забарвлення, яке зникає при додаванні розведених мінеральних кислот:
6СH3COO- + 3Fe3+ + 2H2O → [Fe(СH3COO)6(OH)2]+ + 2H+
Виконання досліду:
У пробірці змішують 2 cм3 нейтрального розчину ацетату і 0,2 cм3 розчину ферум (III) хлориду.
Завдання 5. Характерні реакції аніонів органічних кислот
5.1. Реакції виявлення аніонів органічних кислот
а) Реакції саліцилат-йонів С6H4(OH)COO-
5.1.1. Дія ферум (III) хлориду (фармакопейна)
Cаліцилат-йони при дії розчину ферум (III) хлориду утворюють синьо-фіолетове або червоно-фіолетове забарвлення:


Виконання досліду:
До 2 см3 нейтрального розчину саліцилату додають 2 краплі розчину ферум (III) хлориду, при цьому утворюється характерне забарвлення, яке зберігається при додаванні невеликої кількості розведеної оцтової кислоти, але зникає при додаванні розведеної хлоридної кислоти. При цьому утворюється білий кристалічний осад саліцилової кислоти.
5.1.2. Дія купрум (II) сульфату
Нейтральні розчини саліцилат-йонів при дії розчину купрум (II) сульфату утворюють розчин зеленого кольору:
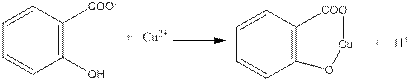
5.2. Реакції тартрат-йонів (НОСHСОO-)2
5.2.1. Дія калію хлориду (фармакопейна)
Тартрат-йони при дії на них калію хлориду в присутності етилового спирту утворюють білий кристалічний осад калію гідротартрату:
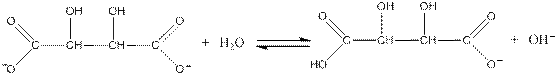

Виконання досліду:
Наливають у пробірку 1 см3 розчину тартрату, додають кристалик калію хлориду, 0,5 см3 етилового спирту і труть скляною паличкою в стінки пробірки. Через деякий час випадає білий кристалічний осад, розчинний у розведених мінеральних кислотах і розчинах лугів. Державна Фармакопея України (ДФУ) проводить дану реакцію в присутності натрію ацетату.
5.2.2. Дія резорцину (фармакопейна)
Тартрат-йони при дії концентрованої сульфатної кислоти перетворюються на гліколевий альдегід, який вступає в реакцію конденсації з резорцином у кето-формі:
|
|
|
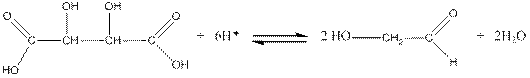
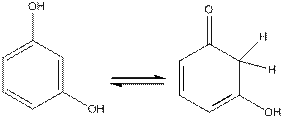
Виконання досліду:
0,25 см3 розчину тартрату нагрівають з 1 см3 концентрованої сульфатної кислоти та декількома кристаликами резорцину. Через деякий час з’являється вишнево-червоне забарвлення.
5.3. Реакції цитрат-йонів (С6H5O7)3-
5.3.1. Дія кальцію хлориду
Цитрат-йони при взаємодії з розчином кальцію хлориду при нагріванні утворюють білий осад:

Виконання досліду:
До 1 см3 нейтрального розчину цитрату додають 1 см3 розчину кальцію хлориду. Розчин залишається прозорим. При кип’ятінні утворюється білий осад, розчинний у розведеній хлорид ній кислоті.
5.3.2. Дія оцтового ангідриду
До 0,1 см3 розчину цитрату додають 0,5 см3 оцтового ангідриду і нагрівають. Через 20-40 секунд з’являється червоне забарвлення
5.4. Реакції бензоат-йонів С6H5СОО-
5.4.1. Дія ферум (III) хлориду (фармакопейна)
Бензоат-йони при дії на них розчину ферум (III) хлориду утворюють рожево-жовтий осад:
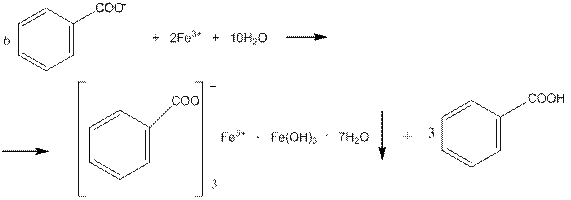
Виконання досліду:
До 2 см3 нейтрального розчину бензоату додають 0,2 см3 розчину ферум (III) хлориду, при цьому утворюється осад, який розчиняється в ефірі. Реакцію слід проводити в нейтральному середовищі, бо в лужному ферум (III) хлорид утворює бурий осад ферум (III) гідроксиду, а в кислому комплексна сіль розчиняється.
5.4.2. Дія купрум сульфату
Нейтральні розчини бензоат-йонів при взаємодії з розчином купрум сульфату утворюють осад бірюзового кольору:

Завдання 6. Аналіз суміші галогенід-аніонів (Cl-, Br-, I--).
Систематичний хід аналізу
6.1. Виявлення йонів Cl-
До окремої порції вихідного розчину додають підкислений нітратною кислотою розчин аргентуму нітрату. При цьому утворюється осад:
Ag+ + Cl- → AgCl↓ ДР=1,78•10-10
Ag+ + Br- → AgBr↓ ДР=5,3•10-13
Ag+ + I- → AgI↓ ДР=8,3•10-17
До утвореного осаду додають 12%-й розчин амонію карбонату, в якому розчиняється лише аргентуму хлорид. Внаслідок гідролізу (NH4)2CO3 утворюється обмежена кількість аміаку, що достатня лише для розчинення аргентуму хлориду, добуток розчинності якого найбільший.
Осад відокремлюють центрифугуванням і не аналізують. До центрифугату додають розчин нітратної кислоти. Утворення білого сирнистого осаду свідчить про присутність хлорид-йонів:
|
|
|
[Ag(NH3)2]+ + Cl- + 2H+ → AgCl↓ + 2NH4+
6.2. Виявлення йонів Br- і I-
До окремої порції вихідного розчину, який підкисляють 1М розчином сульфатної кислоти, додають хлороформ та по краплях хлорну воду. Червоно-фіолетове забарвлення хлороформного шару свідчить про присутність йодид-йонів, які є більш сильними відновниками, ніж бромід-йони і тому оксидуються швидше.
При подальшому додаванні хлорної води, червоно-фіолетове забарвлення зникає внаслідок оксидації I- до IО3- та виникає жовто-гаряче забарвлення хлороформного шару вільним бромом.
Тестовий контроль з теми:
«Вступ. Правила роботи в лабораторії аналітичної хімії. Техніка безпеки. Вимоги до якісного і кількісного аналізу. Кислотно-основна класифікація катіонів. Характерні реакції катіонів I-III-ї аналітичних груп.
Умови їх виконання»
1.
Який аналітичний ефект спостерігається під час визначення катіону калію розчином натрій гексанітрокобальтату (ІІІ)?
A. Білий осад
B. Чорний осад
C. Жовте забарвлення розчину
D. Червоний осад
E. Жовтий осад
2.
Виберіть фармакопейну реакцію на катіони Li+:
A. Дія лугів
B. Немає
C. Дія амонію карбонату
D. Дія хлоридної кислоти
E. Дія флуориду амонію
3.
Яка пара йонів не заважає один одному при виявленні?
A. NH4+, Na+
B. K+, Na+
C. Такої пари для І аналітичної групи немає
D. Li+, NH4+
E. NH4+, K+
4.
Як називаються реакції і реагенти, що дають можливість визначити даний йон у присутності інших йонів?
A. Вибірковими
B. Характерними
C. Груповими
D. Причини, які подані в пунктах В і Д
E. Специфічними
5.
Яка із вказаних реакцій визначення катіонів амонію є специфічною?
A. Реакція з калію тетрайодомеркуратом (П) в лужному середовищі
B. Реакція з калію гексагідроксоантимонатом
C. Реакція з натрію гексанітрокобальтатом (Ш) в кислому середовищі
D. Реакція з гідроксидами лужних металів при нагріванні
E. Реакція з натрію гексанітрокобальтатом (Ш)
6.
Аналізуючий розчин містить катіони калію і натрію. Вкажіть реагент, який дозволяє виявити в цій суміші катіони калію:
A. Кислота щавлева
B. Кислота бензойна
C. Кислота винна
D. Кислота оцтова
7.
Леткі сполуки Натрію забарвлюють полум’я в характерний:
A. Зелений колір
B. Голубий колір
C. Жовтий колір
D. Карміново-червоний колір
E. Фіолетовий колір
8.
Який катіон знаходиться в розчині, якщо при нагріванні його з лугом виділяється газ з різким запахом?
A. Ртуті(І)
B. Амонію
C. Ртуті(ІІ)
D. Срібла
E. Свинцю(ІІ)
9.
При дії амонію карбонату на катіони Li+:
A. Випадає жовтий осад, розчинний в хлоридній кислоті
B. Утворюється білий розчин
C. Розчин знебарвлюється
D. Випадає білий осад, нерозчинний в хлоридній і ацетатних кислотах
E. Випадає білий осад, розчинний в хлоридній і ацетатній кислотах
10.
У фармакопейному аналізі для ідентифікації йонів натрію використовують реакцію з:
A. 2-метоксі-2-фенілоцтовою кислотою
B. Діацетилдіоксимом
C. 8-оксихіноліном
D. Дифеніламіном
E. Тетрафенілборатом
11.
При проведенні аналізу сумішей катіонів за систематичним ходом необхідно відділити катіони першої аналітичної групи. Груповим реактивом для йонів першої аналітичної групи є:
A. Натрію гідроксид
B. Хлоридна кислота
C. Амонію гідроксид
D. Сульфатна кислота
E. Жоден з цих реактивів
12.
Яка з названих реакцій виявлення катіону амонію є надчутливою?
A. Реакція з натрію гексанітрокобальтом (ІІІ)
B. Реакція з лугом під час нагрівання у газовій камері
C. Реакція з натрію гексанітрокобальтом (ІІІ) у кислому середовищі
D. Реакція з калію тетрайодомеркуратом (ІІ) у лужному середовищі
E. Реакція з калію дигідроантимонатом
13.
Яким аналітичним ефектом супроводжується реакція виявлення калію за допомогою натрію гідротартрату?
A. Випадає бурий осад
B. Розчин набуває жовтого забарвлення
C. Випадає жовтий осад
D. Утворюється білий кристалічний осад
E. Утворюється білий аморфний осад
14.
Поділ йонів (катіонів/аніонів) на аналітичні групи проводиться відповідно до:
A. Фізичних властивостей їх сполук
B. Положення елементів у періодичній системі
C. Хімічних властивостей їх сполук із певними реактивами
D. Оксидаційно-відновних властивостей цих йонів
E. Розчинності їх сполук у воді
15.
В якому розчині присутні катіони лише I-ї аналітичної групи?
A. K+, NH4+, Zn2+
B. Na+, Fe2+, Fe3+
C. Na+, K+, NH4+
D. K+, Ag+, Al3+
E. NH4+, Cu2+, Hg22+
16.
На чому ґрунтується розділення аргентум хлориду від гідраргірум (І) хлориду:
A. На різній розчинності у сульфатній кислоті
B. На різній розчинності у хлоридній кислоті
C. На різній розчинності у розчині амоніаку
D. На різній розчинності у гарячій воді
E. На різній розчинності у лугах
17.
При додаванні розведенного розчину хлоридної кислоти до розчину, що аналізується, утворився білий сирнистий осад. Про присутність яких йонів це свідчить?
A. Амонію
B. Феруму (ІІ)
C. Йоду
D. Аргентуму
E. Барію
18.
Для визначення якісного складу препарату на досліджуваний розчин подіяли 2н розчином HCl. Випав білий осад, розчинний у водному розчині аміаку. На наявність яких катіонів вказує цей аналітичний ефект?
A. Меркурію (ІІ)
B. Плюмбуму (ІІ)
C. Аргентуму (І)
D. Меркурію (І)
E. Натрію
19.
До досліджуваного розчину додали 2н розчин HCl. При цьому утворився білий осад, який при обробці розчином аміаку почорнів. Який катіон присутній у розчині?
A. Pb2+
B. Hg22+
C. Ba2+
D. Ag+
20.
Відомо, що до складу досліджуваної суміші входять катіони другої аналітичної групи. До цієї групи належать катіони, які утворюють:
A. Осади із хлоридною кислотою
B. Осади із нітратною кислотою
C. Осади із натрію гідрофосфатом
D. Осади із натрію нітратом
E. Осади з натрію оксидом
21.
До досліджуваного розчину додали розчин калію йодиду. Випав золотисто-жовтий осад, який розчиняється в гарячій воді, надлишку реагенту і в оцтовій кислоті. Це свідчить про присутність в розчині:
A. Катіонів срібла (І)
B. Катіонів ртуті (ІІ)
C. Катіонів вісмуту (ІІІ)
D. Катіонів ртуті (І)
E. Катіонів свинцю (ІІ)
22.
До досліджуваного розчину додали 1М розчин сульфатної кислоти. Випав осад білого кольору, який розчиняється в лугах. Це свідчить про присутність в розчині:
A. Катіонів барію (ІІ)
B. Катіонів свинцю (ІІ)
C. Катіонів ртуті (І)
D. Катіонів срібла (І)
E. Катіонів кальцію (ІІ)
23.
До другої групи катіонів належать катіони Pb2+, Ag+, Hg22+. Вказати груповий реагент для другої групи катіонів:
A. Розчин NH3
B. Розчин H2SO4
C. Розчин HCl
D. Розчин NaOH
E. Група не має групового реагенту
24.
Реакція утворення золотисто-жовтого розчину (реакція «золотого дощу») - це реакція:
A. Утворення осаду PbІ2
B. Утворення осаду HgІ2
C. Утворення осаду PbCl2
D. Утворення осаду AgІ
E. Утворення осаду Hg2І2
25.
Які катіони містилися в розчині, якщо при додаванні до нього хлоридної кислоти утворюється осад, після обробки якого розчином аміаку відбувається часткове розчинення і почорніння осаду?
A. Срібло і ртуті(ІІ)
B. Срібла і барію
C. Ртуті(ІІ) і ртуті(I)
D. Срібла і ртуті(I)
E. Срібла і свинцю
26.
Які катіони I-III аналітичних груп знаходяться в досліджуваному розчині, якщо з розчином лугу утворюється осад, розчинний в надлишку лугу?
A. Ртуті (I)
B. Срібла
C. Барію
D. Кальцію
E. Свинцю (ІІ)
27.
Вкажіть, який реагент використовують для відокремлення осаду AgCl від осаду AgI?
A. Розчин сульфатної кислоти
B. Концентрована нітратна кислота
C. Водний розчин аміаку
D. Концентрований розчин калію хлориду
E. Розведена нітратна кислота
28.
Фармакопейна реакція на катіони Pb2+:
A. Дія хлоридної кислоти
B. Дія калію хромату
C. Дія амонію гідроксиду
D. Дія сульфатної кислоти
E. Дія калію хлориду
29.
При дії калію дихромату на катіони Pb2+:
A. Утворюється жовтий розчин
B. Випадає жовтий осад
C. Розчин знебарвлюється
D. Випадає білий осад
E. Випадає чорний осад
30.
До розчину, який містить катіони ІІ аналітичної групи додали невелику кількість концентрованого розчину амоніаку і 3-4 краплі розчину формальдегіду. Пробірку занурили у гарячу воду і на стінках пробірки з’явилась дзеркальна плівка. Наявність якого катіону обумовлює цю реакцію?
A. Меркурію (І)
B. Барію
C. Плюмбуму
D. Літію
E. Арґентуму
31.
У якісному аналізі для визначення йонів стронцію використовують гіпсову воду. Гіпсова вода – це:
A. Насичений розчин вуглекислого газу у воді
B. Насичений розчин барію гідроксиду
C. Насичений розчин кальцію сульфату у воді
D. Розчин кальцію гідроксиду
E. Розчин барію нітрату у воді
32.
Який аналітичний ефект слід чекати від дії калію гексаціаноферату (ІІ) на катіони Са2+?
A. Появу коричневого забарвлення
B. Утворення білого дрібнокристалічного осаду
C. Появу бурого кільця
D. Випадання жовто-зелених кристалів
E. Утворення комплексної сполуки голубого кольору
33.
При аналізі фармпрепарату необхідно провести переосадження сульфатів катіонів ІІІ аналітичної групи у карбонати. Вкажіть реагент, за допомогою якого можна провести таке переосадження:
A. Гіпсова вода
B. Баритова вода
C. Насичений розчин натрій карбонату
D. Натрій хлорид
E. Натрій гідрогенкарбонат
34.
За кислотно-основною класифікацією до ІІІ аналітичної групи катіонів відносяться Ca2+, Sr2+, Ba2+. Вкажіть груповий реагент цієї групи:
A. Кислота щавелева
B. Кислота сульфатна + етанол
C. Кислота хлоридна
D. Кислота нітратна
E. Кислота оцтова
35.
В аналізованому розчині міститься кальцію хлорид і натрію бромід. Для ідентифікації йона кальцію до аналізованого розчину додали розчин:
A. Калію перманганату
B. Натрію хлориду
C. Барію хлориду
D. Калію йодиду
E. Амонію оксалату
36.
В якому розчині присутні катіони лише III-ї аналітичної групи (кислотно-основна класифікація):
A. Na+, K+, NH4+
B. Na+, NH4+, Ca2+
C. Hg2+, Co2+, Ni2+
D. Са2+, Sr2+, Ba2+
E. Zn2+,Cr3+, Со2+
37.
В якісному аналізі при осадженні сульфатів катіонів третьої аналітичної групи (Ca2+, Sr2+, Ba2+) з метою зменшення розчинності сульфатів у розчин додають:
A. Розчин аміаку
B. Етиловий спирт
C. Трилон Б
D. Крохмаль
E. Нітратну кислоту
38.
Виберіть реагент для розділення катіонів Sr2+ і Са2+ в суміші:
A. 1М розчин Na2HPO4
B. 30% розчин CH3COONH4
C. Концентрований розчин Na2CO3
D. 5М розчин K3[Fe(CN)6]
E. Концентрований розчин (NH4)2SO4
39.
Який катіон Ш-ї аналітичної групи знаходиться в розчині, якщо при нагріванні з гіпсовою водою через деякий час розчин мутніє?
A. Кальцію
B. Магнію
C. Стронцію
D. Ртуті (II)
E. Свинцю (II)
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2236; Нарушение авторских прав?; Мы поможем в написании вашей работы!