
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алыпты таралу 1 страница
|
|
|
|
ТАРАУ
Аналитикалық химияның метрологиялық негіздері
Метрология (грекше metron – өлшеу және logos – ұғым, ілім, ғылым) – өлшеу туралы, өлшеудің әдіс-тәсілдері туралы ғылым. Метрологияның әртүрлі ғылым салаларындағы, соның ішінде химиялық анализдегі маңызы өте зор. Химиялық анализ метрологиясы стандарттауда, өнеркәсіпті интенсивтендіруде, өнімнің сапасын жоғарылатуда, қоршаған ортаны қорғауда және т.б. маңызды орын алады.
Химиялық анализ – күрделі және көп сатылы үдеріс. Кез-келген нысанның анализін мынадай кезеңдерге бөлуге болады: мақсатты айқындау, әдіс пен анализ жобасын таңдау, сынаманы таңдау, сынаманы анализге дайындау, өлшеу жүргізу, өлшеу нәтижелерін өңдеу. Мұндай бөлу шартты: әрбір кезең салыстырмалы түрде күрделі болуы және көптеген жеке сатылардан тұруы мүмкін. Осы тарауда біз химиялық анализ әдісін таңдау мен өлшеу нәтижелерін өңдеуді, сонымен бірге «өлшеу» кезеңінің кейбір жалпы ережелерін қарастырамыз.
Химиялық анализдің негізгі мақсаты – зат мөлшерін анықтау, сондықтан, анализ кезеңдерін қарастырудан бұрын осы оқулықта қолданылатын зат мөлшерінің өлшем бірліктері мен концентрацияны белгілеу жолдарын келтірсек.
2.1. Зат мөлшерінің өлшем бірліктері және
концентрацияны өрнектеу жолдары
Зат мөлшерінің өлшем бірліктері. Моль. Зат мөлшерінің өлшем бірлігі ретінде бір моль қабылданған. Бұл 0,012 кг көміртегінде қанша атом болса, сонша шартты бөлшегі, яғни құрамында 6,02045·1023 шартты бөлшегі бар зат мөлшері. Шартты бөлшек молекула, ион, электрон немесе бөлшектер тобы (мысалы, функционалды топ, молекуланың бөлігі, ассоциат, радикал және т.б.) болуы мүмкін. Бір сөзбен айтқанда, шартты бөлшек – кез-келген дискретті материалды бірлік. Кейбір шартты бөлшектер шын мәнінде кездесетін болса (Н2 молекуласы, IO3-), кейбіреуі шартты түрде болады (ерітіндідегі NaCl молекуласы, молекуланың жартысы, ерітіндідегі протон саны). Сондықтан шартты бөлшектердің «моль» бірлігі қолайлы және әдетте микрообъектілердің мөлшерін өрнектеу үшін қолданылады.
|
|
|
Заттың моль санын n символымен белгілейді. n (H+)=1,0·10-6 жазылуы 6,02·1023·10-6 протонды білдіреді; n (HCl)=0,01 моль – HCl шартты бөлшектерінің 6,02·1023·0,01 молі; n (1/5KMnO4)= =0,05 моль – 1/5KMnO4 шартты бөлшектерінің 6,02·1023·0,05 молі; n (e)=1 моль – 6,02·1023 электрон. Химиялық анализ практикасында мұндай мәлімет сирек қажет болады.
Молярлы масса (М) – бұл 1 моль заттың массасы. Егер массасы m зат берілген болса, онда М=m/n. Молярлы массаның өлшем бірлігі г·моль-1. Саны жағынан молярлы масса салыстырмалы молекулалық массаға тең, яғни бөлшектегі барлық атомдардың қосынды массасының көміртегі атомының 1/12 массасына қатынасына тең. Салыстырмалы молекулалық масса – мөлшерсіз шама, оны элементтердің атомдық массаларының кестесі бойынша оңай есептеуге болады.
Молярлы көлем (V0) – бұл қалыпты жағдайдағы 1 моль заттың көлемі. Әдетте бұл шаманы газдар үшін қолданады, бұл жағдайда V0 =22,4 л·моль-1.
Молярлы заряд (Q) – бұл 1 моль заттың жалпы заряды. Бір зарядты бөлшектер үшін Q =96485 Кл·моль-1 (число Фарадея, F), z – зарядты бөлшектер үшін Q=zF.
|
|
|
Концентрацияны белгілеу жолдары. Аналитикалық химияда көбінесе заттың белгілі бір көлемдегі мөлшерімен, яғни концентрациясымен жұмыс істеу керек болады. Әсіресе бұл ерітіндідегі заттар үшін маңызды. Көлемнің өлшем бірлігі 1 литрге (л) тең болатын кубты метр (м3) немесе кубты дециметр (дм3).
Молярлы концентрация с – еріген заттың моль санының ерітінді көлеміне қатынасы. Бұл термин шартты бірліктердің кез-келген түріне (атомдар, иондар, молекулалар, молекулалардың бөлігі және т.б.) қатысты. Молярлы концентрация (моль·дм-3 немесе моль·л-1) – бұл 1 литр ерітіндідегі еріген заттың моль санын (молін) өрнектейді және көбінесе М деп белгіленеді. Мысалы, с (HCl)=0,1 моль·л-1 немесе с (HCl)=0,1 М; с (1/5KMnO4)=0,05 моль·л-1 немесе 0,05 М (1/5KMnO4).
Сонымен, молярлы концентрация – М: 1 дм3 (л) ерітіндідегі еріген заттың моль саны – nA немесе 1 см3(л) ерітіндідегі заттың ммоль саны: 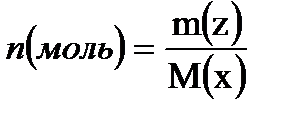 ;
; 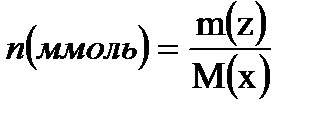 . Бұндағы М(х) – молярлық масса, яғни 1 мольдің массасы.
. Бұндағы М(х) – молярлық масса, яғни 1 мольдің массасы. 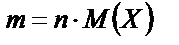 ; А заты үшін
; А заты үшін 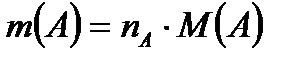 . Мысалы: 0,2М H2SO4:
. Мысалы: 0,2М H2SO4: 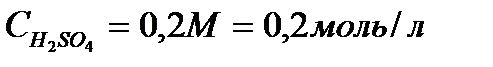
Бір мольдің массасы: M(H2SO4)=98,08 г/моль. 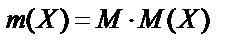 ;
; 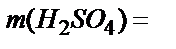 0,2 моль/л. 98,08г/моль=19,6 г/л
0,2 моль/л. 98,08г/моль=19,6 г/л
Шартты бірліктердің молярлы концентрациясын бұрын нормальды концентрация деп атайтын және N деп белгілейтін.Қазіргі кезде бұл терминді көп қолданбайды. Нормальды концентрация – N: 1дм3 (л) ерітіндіде еріген заттың моль-эквивалент саны (nэ) немесе 1см3 (мл) ерітіндіде еріген заттың ммоль-эквивалент саны.
Эквивалент. Қосылыстағы шартты бірліктер арасында стехиометриялық деп аталатын белгілі қатынастар болады. Мысалы, NaCl молекуласында натрийдің бір атомына хлордың бір атомы келеді, Na2CO3 молекуласында екі протон бір CO32- бөлшегімен байланысқан. Реакцияланушы бөлшектер арасында да стехиометриялық қатынас орнайды, мысалы:
a A+ b B c C+ d D
реакциясында А затының a шартты бөлшегі В затының b шартты бөлшегімен реакцияға түседі. Осыған сәйкес, 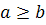 шарты орындалған кезде А затының бір бөлшегі В затының b/а бөлшектеріне эквивалентті. b/а қатынасын В затының эквивалент факторы деп атайды және fэкв (В) деп белгілейді. Мысалы:
шарты орындалған кезде А затының бір бөлшегі В затының b/а бөлшектеріне эквивалентті. b/а қатынасын В затының эквивалент факторы деп атайды және fэкв (В) деп белгілейді. Мысалы:
2Na2S2O3+I2 Na2S4O6+2NaI
реакциясында fэкв (I2)=1 / 2, ал эквивалент 1/2 I2 бөлшегі болып табылады.
|
|
|
Қышқылды – негіздік реакцияларда эквивалент – осы реакцияда сутегінің бір ионымен байланысатын, оны ауыстыратын немесе бөліп шығаратын шартты бөлшек. Тотығу – тотықсыздану реакцияларында эквивалент – осы реакцияда бір электронды қосып алатын немесе беріп жіберетін шартты бөлшек.
Реакцияға байланысты бір заттың эквиваленті әртүрлі болуы мүмкін. Мысалы:
HCl+Na2CO3 NaHCO3+NaCl
реакциясында натрий карбонатының эквиваленті – Na2CO3 шартты бөлшегі (fэкв =1). Ал
HCl+Na2CO3 2NaCl+H2CO3
реакциясында fэкв (Na2CO3)=1 / 2, ал эквивалент 1 / 2 Na2CO3 шартты бөлшегі болып табылады.
Заттар бір бірімен өздерінің эквиваленттеріне байланысты реакцияласады – бұны Дальтонның еселік қатынас заңы дейді. Бұл заң аналитикалық химияда барлық сандық есептеулерде қолданылады, әсіресе титриметриялық анализ әдістерінің негізін құрайды. Практика жүзінде жеке эквиваленттермен немесе химиялық актпен ғана емес, бөлшектердің үлкен бірлігімен жұмыс істейді. Бұл жағдайда заттар арасындағы стехиометриялық қатынастар заттар мөлшерінің мольдік қатынасы түрінде болады:
n(A):n(B)=a:b.
Эквиваленттік фактор – берілген реакцияда реальды заттың қандай үлесі 1 сутегі атомына (не 1 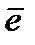 -ға) эквивалентті екенін көрсететін сан. Эквиваленттік фактор мына теңдеу бойынша анықталады:
-ға) эквивалентті екенін көрсететін сан. Эквиваленттік фактор мына теңдеу бойынша анықталады: 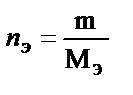 .
.
Мысалы, мына 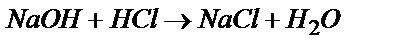 реакция бойынша NaOH-тың эквиваленттік факторы бірге тең.
реакция бойынша NaOH-тың эквиваленттік факторы бірге тең.
Басқа да мысалдар келтірсек:
H2SO4+2NaOH=Na2SO4+2H2O немесе
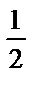 H2SO4+NaOH=
H2SO4+NaOH= 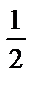 Na2SO4+H2O
Na2SO4+H2O
H2SO4- тің моль×экв 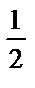 – ге тең болады, яғни
– ге тең болады, яғни 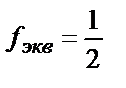 ;
;
1моль×эквиваленттің массасы мына теңдеумен анықталады: Mэ(А) = fэ кв(А)×М(А).
f экв мәні жүретін әрбір химиялық реакцияның теңдеуіне байланысты анықталады:
H3PO4+NaOH=NaН2PO4+H2O; 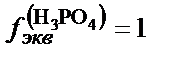
H3PO4+2NaOH=Na2HPO4+2H2O; 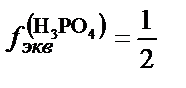 ;
;
H3PO4+3NaOH=Na3PO4+3H2O; 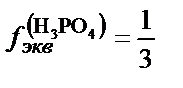 ;
;
Na2CO3+2HCl=2NaCl+H2CO3; 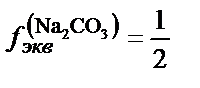
Концентрацияны өрнектеудің басқа да әдістерін қарастырсақ.
Массалық концентрация – еріген зат массасының mS ерітінді көлеміне V қатынасы, массалық концентрацияның өлшем бірлігі кг·дм-3 немесе кг·л-1, сонымен бірге еселік бөлшектік бірліктер. Бір миллилитрдегі заттың грамымен өрнектелген массалық концентрацияны титр деп атайды. Классикалық анализ әдісінің бірі титриметрияның аталуы осы терминмен байланысты.
|
|
|
Титр – T әрпімен белгіленеді, оның өлшем бірлігі: мг/мл немесе г/мл. Ерітінді титрі мына теңдеумен анықталады: 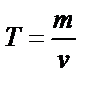 ; Бұндағы, m – еріген заттың массасы, v – ерітіндінің көлемі.
; Бұндағы, m – еріген заттың массасы, v – ерітіндінің көлемі.
Молярлы концентрация: 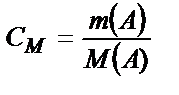 бұндағы М(А) – молярлы масса, яғни 1 мольдің массасы. Осыдан
бұндағы М(А) – молярлы масса, яғни 1 мольдің массасы. Осыдан 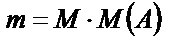
Сонда: 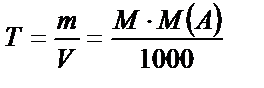 ;
;
Яғни титрді молярлы концентрация арқылы да табуға болады. Осы сияқты, титрді нормальды концентрация арқылы да табу жолы бар. 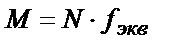 екенін білеміз.
екенін білеміз.
Олай болса:
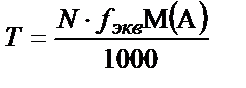 немесе
немесе 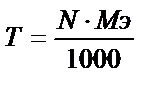 ;
;
Титрі белгілі болған жағдайда M не N – концентрацияларды да осы теңдеуден табуға болады.
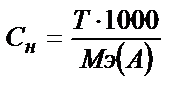 ;
; 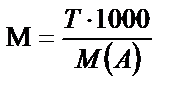
Кей жағдайда жұмысшы ерітіндінің анықтайтын зат арқылы титрі – Tж/А беріледі, бұл анықтайтын заттың 1 мл жұмысшы ерітіндімен (титрантпен) әрекеттесетін грамм мөлшері.
Мыс: 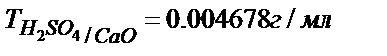 ;
; 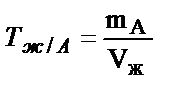 ;
; 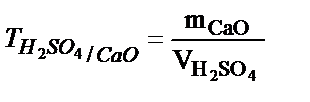 ;
;
немесе 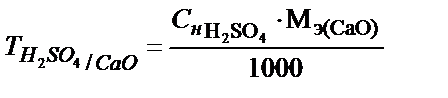 . Олай болса:
. Олай болса:
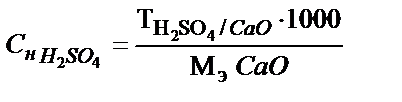 ;
;
Яғни жалпы түрде:
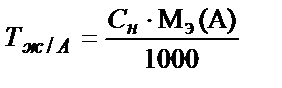 ;
; 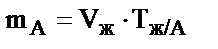
Көлемдік концентрация – еріген заттың көлемінің ерітінді көлеміне қатынасы.
Көп жағдайда ерітіндінің немесе басқа нысанның құрамын заттың жалпы мөлшеріндегі компоненттің үлесі түрінде өрнектейді. Өрнектеудің мұндай жолының қолайлы болуы нысанның агрегатты күйіне тәуелді еместігінде. «Үлес» компонент бөлшектері санының нысан бөлшектерінің жалпы санына қатынасын білдіреді. Таңдап алынған бірлікке байланысты молярлы (α), массалық (ω), көлемдік (φ) үлес деп бөлінеді:
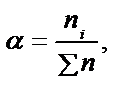
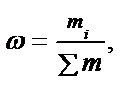
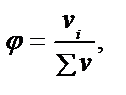 .
.
Үлесті пайызбен көрсетеді. Пайызбен көрсетілген массалық үлесті проценттік (пайыздық) концентрация деп атайды. Проценттік концентрация С%; ω % – деп белгіленеді. Заттың өте аз мөлшерін бағалау үшін миллиондық үлесті – ppm, миллиардтық үлесті – ppb, триллиондық үлесті – ppt қолданған қолайлы.
Бір мысал келтірсек. 1 литр итмұрын тұнбасындағы аскорбин қышқылының құрамы 5,5 мг. Аскорбин қышқылының құрамын массалық үлеспен көрсету керек.
Ерітіндідегі аскорбин қышқылының массалық үлесін (1 литрдің массасы 103 грамм екенін ескере отырып) табамыз:
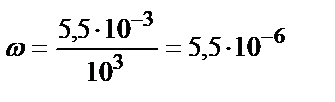 .
.
Бұл сан есептеуге қолайсыз. Оны ppm немесе млн-1 бірлігіне ауыстырамыз:
5,5 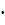 10-6
10-6 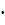 106 = 5,5 млн-1.
106 = 5,5 млн-1.
Моляльдық – ерітіндінің масса бірлігіндегі (1кг) зат мөлшері. Моляльдықтың ерекшілігі температураға тәуелсіздігінде. Бірақ аналитикалық химияда бұл бірлікті сирек қолданады.
2.2. Анализ әдісін таңдау
Анлиз әдісін таңдай отырып, ең алдымен анализдің мақсатын, сонымен бірге қандай мәселелерді шешу керектігін жете білу керек, қолдануға болатын әдістердің артықшылықтары мен кемшіліктерін бағалау қажет. Химиялық анализде шешілетін мәселелер күрделі және алуан түрлі.
Қандай да бір әдісті таңдау кезінде назар аударуға тиісті факторларды қарастырудан бұрын, әдіс пен әдістеме түсініктерін талқылап алған дұрыс. Әдіс – бұл нақты нысан (объекті) мен анықталатын затқа қатыссыз анализдің негізін құрайтын принциптер жиынтығы; әдістеме – белгілі бір нысанды (объектіні) анализдеуге қажетті барлық шарттар мен операциялардың толық жазбасы. Мысалы, гравиметриялық анализ әдісінің негізін құрамында анықталатын компонент болатын қосылыстың массасын анықтау құрайды. Компонентті гравиметриялық әдіспен анықтаудың әдістемесіне мыналар кіреді: аз еритін қосылысты тұнбаға түсіру жағдайларын, тұнбаны ерітіндіден бөліп алу жолын, тұндырылған заттарды өлшеуге қолайлы, яғни тұнбаның өлшенетін түріне ауыстыруды сипаттап жазу. Нақты нысандағы компонентті анықтаудың әдістемесіне сынаманы таңдап алу мен оны анализге дайындау операциялары да кіреді (мысалы, үлгіні қолайлы ерітіндіде еріту және анықтауға кедергі келтіретін заттардың әсерін жою). Әдіс пен әдістемені таңдау кезінде назар аударатын негізгі факторларды қарастырсақ.
Компоненттің құрамы. Анализ әдісін таңдау кезінде анықталатын немесе ашылатын компоненттің мүмкін болатын мөлшерін ескеру қажет. Әсіресе үлгідегі компоненттің пайыздық құрамын, анализденетін ерітіндідегі концентрациясын ғана емес, анализге алуға болатын заттың мөлшерін де бағалаған маңызды.
Анықталатын компоненттің концентрациясы мен анализге берілетін үлгінің мөлшері кең аралықта өзгеруі мүмкін. Мыстың, никельдің, хромның өз құймаларындағы құрамы ондаған пайызды, ал кендер мен басқа металдардың құймаларындағы құрамы оннан бір және жүзден бір пайызды құрауы мүмкін. Сонымен бірге осы металдардың өсімдіктер мен тірі организмдердегі, тамақ өнімдеріндегі құрамын 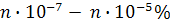 – бен, ал өте таза заттарда –
– бен, ал өте таза заттарда – 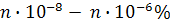 аралықтарында анықтау қажет. Анализге алынатын үлгінің мөлшері бір жағдайларда шектелмеуі мүмкін, ал басқа жағдайларда (қанның, биомассалардың, космостық нысандардың анализінде) өте аз мөлшерде (миллиграмм немесе тіпті миллиграмның үлестері) болады.
аралықтарында анықтау қажет. Анализге алынатын үлгінің мөлшері бір жағдайларда шектелмеуі мүмкін, ал басқа жағдайларда (қанның, биомассалардың, космостық нысандардың анализінде) өте аз мөлшерде (миллиграмм немесе тіпті миллиграмның үлестері) болады.
Әдістің немесе әдістеменің сезімталдығы осы әдіс пен осы әдістеме арқылы анықтауға немесе ашуға болатын минимальды зат мөлшерімен анықталады. 2.1 – суретте кейбір анализ әдістерінің сезімталдықтарының салыстырмалы сипаттамасы берілген. Анықталатын мөлшердің төменгі шегі әдістің мүмкіндіктерін және бірқатар заттарды анықтаған кезде қол жететін ең жақсы нәтижені көрсетеді.
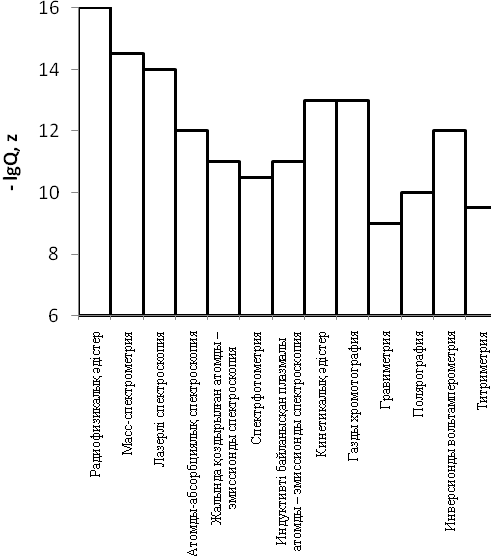
2.1 – сурет. Кейбір анализ әдістері үшін компоненттердің анықталатын мөлшерлерінің төменгі шегі (-lgQ,z)
Әдістің таңдамалылығы. Анализ жүргізген кезде әртүрлі нысандармен – өнеркәсіп және ауылшаруашылығы өнімдерімен, қоршаған орта нысандарымен, космостық нысандармен, қолөнер өнімдерімен және т.б. жұмыс істейді. Осы кезде анализ әдісі мен әдістемесін таңдау анализдің мақсатымен ғана емес, сонымен бірге үлгінің қасиеттері және ерекшеліктерімен де анықталады. Анализденетін нысанның физикалық қасиеттерін: агрегаттық күйін, ұшқыштығын, гигроскопиялығын, механикалық төзімділігін және т.б. ескеру қажет. Анализ әдісін таңдаған кезде үлгінің химиялық қасиеттерін білу және оларды ескеру өте маңызды. Көп жағдайда анализденетін нысанның матрицасы деп аталатын үлгінің түпкі негізінің химиялық қасиеттерін; үлгінің сапалық химиялық құрамын; анықталатын компоненттің және онымен бірге жүретін қоспалардың химиялық қасиеттерін білу және ескеру қажет.
Анализденетін нысанның түпкі негізінің және болжанған компоненттерінің химиялық қасиеттерін біле отырып, мүмкін болатын кедергілерді бағалай отырып, мүмкіндігінше ең таңдамалы әдісті, яғни берілген жағдайларда бірге жүретін басқа компоненттердің келтіретін кедергі әсерінсіз қажетті компонетті анықтауға немесе ашуға болатын әдісті таңдап алады. Химиялық әдебиетте «таңдамалылық» терминімен бірге «селективтік» термині қолданылады. Егер әдістемелер немесе қолданылатын реакциялар тек қана бір компонентті табуға немесе анықтауға мүмкіндік беретін болса, оларды спецификалық деп атайды.
Компонентті анықтау немесе ашудың негізін құрайтын әдістің, әдістеменің және жеке реакцияның таңдамалылығы туралы айтуға болады. Ионометрия, атомды – абсорбциялық және ферментативті әдістер жоғары таңдамалылығымен сипатталады. Әдістемелердің негізін құрайтын көптеген реакциялардың да таңдамалылығы өте жоғары. Мысалы, кейбір органикалық реагенттермен комплексті қосылыстардың түзілуі, ферментативті және электрохимиялық реакциялар. Йодтың крахмалмен немесе аммоний ионын ашуда қолданылатын құрамында аммоний бар заттардың сілтілермен амииак газын бөле жүретін реакциясы да спецификалық реакциялар.
Химиялық анализдің әдістемесін анализ жүргізу шарттарын (ортаның рН, реагенттердің концентрациясы, еріткіш және т.б.) өзгерте отырып; кедергі жасаушы компоненттердің әсерін оларды реакцияға қабілетсіз түрге ауыстыра отырып бүркемелеу немесе оларды негізгі компоненттен бөле отырып (тұндыру, экстракция, хромотография) оның таңдамалылығын арттыруға болады. Жоғары таңдамалы әдістеменің мысалы ретінде құрыштағы никельді оның диметилглиоксиммен түзетін аз еритін комплексті қосылысы түрінде тұндырып гравиметриялық әдіспен анықтауды келтіруге болады. Тұндыруды әлсіз аммиакты ортада жүргізеді, темірді шарап немесе лимон қышқылымен бүркемелейді.
Әдістер мен әдістемелерді қарастыра отырып,олардың әмбебаптығы – көптеген компоненттерді анықтау және ашу мүмкіндігі туралы айту керек. Әсіресе бір сынамадан бірден көптеген компонентті анықтау немесе ашу мүмкіндігі болуының, яғни көпкомпонентті жүйелердің анализін жүргізудің мәні өте зор. Әдістің жоғары таңдамалылығы және оның әмбебаптығы бір- біріне қайшы келмейді: көптеген әмбебап анализ әдістері жеке компоненттерді анықтаудың жоғары таңдамалылығымен ерекшеленеді, мысалы, хромотография, вольтамперометрияның кейбір түрлері, атомды-эмиссионды спектроскопия сияқты әдістер. Атомды-эмиссионды спектроскопия әдістерімен индуктивті байланысқан плазма мен квантометрлерді қолдана отырып бір сынамадан (бөлусіз) әртүрлі 25-30 элементтерді анықтауға болады.
Анализ дәлдігі – бұл әдістің немесе әдістеменің дұрыстығы мен қайталанымдылығын біріктіретін жиынтық сипаттама. Жоғары дәлдік туралы айтқанда нәтижелердің дұрыс және анализ мәліметтерінің шашырауы аз екендігі туралы сөз болады. Дәлдікті жиі анықтаудың пайызбен көрсетілген салыстырмалы қателігімен сипаттайды.
Анализдің дәлдігіне қойылатын талаптар әдетте анализдің міндеті және мақсаттарымен, нысанның табиғатымен анықталады. Үнемі жоғары дәлдікке ұмтылу міндетті емес. Мысалы, көптеген металлургиялық және химиялық өндірістердің ағымды бақылауы кезінде компоненттерді анықтауды 10-15% қателікпен жүргізуге болады. Негізгі компоненттің де және зиянды қоспалардың да құрамын нақты білу маңызды болған жағдайда (мысалы, фармацевтикалық және тамақ өнеркәсібінде), қателік 0,1-1% – дан жоғары болмау керек. Жартылай өткізгіштер үшін анықтаудың қателігі 0,1% – дан, мүмкін болса 0,01% – дан төмен болу керек, өйткені бұл қосылыстардың физикалық қасиеттері олардың стехиометриялық құрамына тәуелді.
Гравиметриялық және титриметриялық әдістерді айтарлықтай дәл деуге болады, әдетте олардың дәлдігі сәйкесінше 0,05-0,2 және 0,1-0,5% болады. Заманауи әдістердің ішінде кулонометриялық әдіс әлдеқайда дәлірек. Бүл әдіс компоненттерді 0,001-0,01% қателікпен анықтауға мүмкіндік береді.
Әдетте химиялық анализдің дәлдігіне талаптарды технологтар, геологтар, медиктер, физиктер және т.б. қояды. Ал химик-аналитиктердің анализ жүргізген кезде қандай да бір дәлдікке жету қажеттілігі туралы өзіндік түсініктері болуы керек. Анықтаудың жоғары дәлдігін жөнсіз талап ету химиялық анализді ұзартады және қымбатқа түсіреді. Компоненттер қатарын анықтау дәлдігін 2 ден 0,2 %-ға жеткізгенде анализ уақыты 20 ретке артады. Дәлдікке деген талапты арттыру көбінесе күрделі және қымбат құралдарды қолдануды қажет етеді. Сонымен, дәлдігі жоғарырақ әдісті немесе дәлдігі төменірек әдісті таңдау зерттеушіден (әсіресе массалық химиялық анализ жүргізген кезде) жан-жақтылықты талап етеді.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2182; Нарушение авторских прав?; Мы поможем в написании вашей работы!