
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тест тапсырмалары
|
|
|
|
ТАРАУ
Комплекс түзу реакциялары
7.1. Комплексті қосылыстардың негізгі сипаттамалары
Комплекстік қосылыстар орталық ионнан (атом) М және онымен байланысқан лигандтардан L тұрады. Орталық ионды комплекстүзгіш деп атайды. Комплекстүзгішпен байланысқан лигандтар зарядталған не бейтарап бейорганикалық, не органикалық бөлшектер болуы мүмкін. Комплекстүзгіш лигандтармен бірге қосылыстың ішкі координациялық сферасын (өрісін) құрайды.
Егер комплекстік қосылыс зарядталған ион түрінде жүрсе, оның сыртқы координациялық сферасы пайда болады. Бұл электростатикалық күшпен байланысқан теріс не оң зарядталған иондар. Мысалы:
K4 [Fe(CN)6]↔ 4K++[Fe(CN6)]4-
[Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ +Cl-
[Fe(CN6)]4-, [Ag(NH3)2]+ -ішкі координациялық сфера, яғни комплекстік иондар. K+, Cl- – сыртқы координациялық сфера. Әдетте комплекстүзгіш ролін электрондары d-орбитальда орналасқан металл иондары атқарады: Ti, Cr, Mn, Fe, Co, Ni, Cu, Mo, W, Pd, Pt, Ag т.б.
Лигандтардың координациялық байланыс түзу қабілеттілігі дентаттықпен сипатталады. Кейбір лигандтар комплекстүзгіштің бірден артық атомдармен байланысып координациялық сферада бірден артық орын алады. Мұндай лигандтар полидентатты деп аталады. Моноденттатты лигандтар координациялық орталықпен тек бір атоммен (ионмен) байланысып координациялық сферада тек бір орын алады.
Моноденттатты лигандтар: Cl-, NH3, H2O2, CN- т.б.
Полиденттатты лигандтар: C2O42-, PO43-, орагникалық лигандтар, мысалы:
НООСН2С СН2СООН
N – CH2 – CH2 – N
НООСН2С СН2СООН
Комплесктүзгіш координациялық санмен сипатталады. Координациялық сан – комплекстүзгіш пен лигандтардың арасындағы байланыс саны. Егер лиганд монодентатты болса оның комплекстегі саны координациялық санға сәйкес келеді. Мысалы: K3 [Fe(CN)6] комплексінде CN- – монодентатты лиганд, комплекстүзгіш Fe3+ ионының координациялық саны алтыға тең; [Ag(NH3)2]Cl комплексінде NH3 -монодентатты, Ag+-тің координациялық саны екіге тең; [Fe(PO4)2]Cl3 комплексінде PO43- -үшдентатты, Fe3+ -тің координациялық саны алты.
|
|
|
Нақтылы жағдайда бір лиганд әртүрлі дентаттық қасиет көрсетуі мүмкін. Мысалы, алтыдентатты лиганд этилендиаминтетрасіркеқышқылы екі зарядталған катионмен төрт байланыс, ал үш зарядталған катиондармен бес байланыс түзіп байланысады:
| |||||||||||||
|
Полидентатты лигандтармен түзілген комплекстерді хелатты, ішкі комплексті қосылыстар дейді. Комплекстүзгіштердің негізгі координациялық саны 4 пен 6, сирек -2 мен 8, одан да сирек -5 пен 7 болады.
Комплекстүзгіштің санына қарай комплекстік қосылыстар моноядролы – бір комплекстүзгіш [Fe(CN)6]4-, және полиядролы – екі, не одан да көп комплекстүзгіш [АІ2Сl6] болып бөлінеді. Полиядролы комплекстерге полиқышқылдар мен полисульфидтер жатады.
Комплекстүзу процесі ертіндідегі лигандтың концентрациясына байланысты сатылай жүреді, сондықтан құрамы әр түрлі бірнеше комплекстік қосылыс түзілуі мүмкін. Мысалы, мыс (П) пен аммиак әрекеттескенде тізбектеп бір-, екі-, үш- және төрт аммиакты мыс пайда болады: [Сu(NH3)]2+, [Сu(NH3)2]2+, [Сu(NH3)3]2+, [Сu(NH3)4]2+.
|
|
|
Комплекстік қосылыстардың бірқатар бағалы қасиеттері бар:
1) Комплекстің құрамына кіретін комплекстүзгіш пен лигандтар ертіндіде бос түрінде жүрмейді. Ішкі координациялық сфераға кірген қарапайым бөлшектердің қасиеті өзгереді.
2) Комплекстік қосылыстардың көпшілігінің өзіне тән бояуы болады.
3) Көптеген комплекс түзу реакциясы толық, аяғына дейін жүреді.
4) Комплекс түзу реакциялары таңдамалы жүреді.
7.2.Комплекс түзу реакцияларының тепе-теңдік константалары
Судағы ертіндіде металл иондары гидратталған, яғни аквакомплекс түрінде жүреді М(Н2О)n+. Ертіндіге комплекс түзетін лигандтарды қосқанда ішкі координациялы сферадан су молекулалары ығыстырылып, олар лигандтармен алмасады:
М(Н2О)m + nL ↔ MLn + mН2О (7.1)
Реакцияның жазылуын қарапайымдату үшін аквакомплекстердің түзілу және бұзылу процестерін еске алмай, комплекстүзу реакциясы тікелей комплекстүзгіш пен лигандтың арасында жүреді деп қарастыруға болады:
M +nL ↔ MLn (7.2)
(7.2) реакциясының тепе-теңдік константасы қаншалықты келтірілген реакция аяғына дейін жүретінін көрсетеді, ол комплекстің тұрақтылық константасы (β) деп аталады:
βn = a MLn / aM∙aLn (7.3)
MLn комплексінің түзілуі сатылай жүреді:
M + L ↔ ML1
ML1 + L ↔ ML2
ML2 + L ↔ ML3... (7.4)
MLn-1 + L ↔ MLn
Әр сатыға сәйкес өзінің сатылай тепе-теңдік константасы болады:
β1 =  / aM∙aL
/ aM∙aL
β2 =  /
/  ∙aL (7.5)
∙aL (7.5)
β3 = 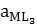 /
/  ∙aL.......
∙aL.......
βn = 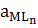 /
/  ∙aL
∙aL
β1, β2,........ βn-сатылай тұрақтылық константалары. Келтірілген комплекстүзу реакцияларын басқаша толық реакция түрінде жазуға болады:
M + L ↔ ML1 β1 = aML / aM∙aL
M + 2L ↔ ML2 β1,2 = β1∙β2=  / aM∙aL2
/ aM∙aL2
M + 3L ↔ ML3... β1,3=β1∙β2∙β3= 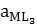 / aM∙aL3..... (7.6)
/ aM∙aL3..... (7.6)
M+ nL ↔ MLn β1,n = β1∙β2∙β3… βn= 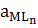 / aM∙aLn
/ aM∙aLn
(7.3-7.6) теңдіктерінде келтірілген тұрақтылық константалары компоненттердің активтіктерімен белгіленетіндіктен олар термодинамикалық тұрақтылық константалары болады. Ал концентрациялық тұрақтылық константалары ерітіндінің иондық күшіне байланысты:
|
|
|

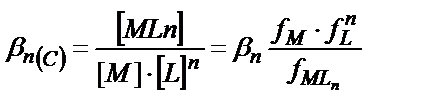 (7.7)
(7.7)
Иондық күші тұрақты ерітінділерде концентрациялық тұрақтылық константалар мәні өзгермей тұрақты болып қалады, сондықтан βn(С) пайдаланып тікелей ерітінділердегі тепе-теңдік концентрацияларды есептеуге болады.
Комплекстүзу тепе-теңдігін сипаттау үшін комплексті қосылыстың қаншалықты толық түзілгенін көрсететін функция F(L) (комплекстену функциясы) пайдаланылады. F(L) – металл иондарының жалпы концентрациясы См мен оның комплекс түзбеген бөлігінің тепе-теңдік концентрациясының қатынасы ([М]):
F(L) = СМ / [M]
СМ=[M]+ [ML]+ [ML2]+….. [MLn];
Комплексті иондардың тепе-теңдік концентрацияларын олардың сатылай тұрақтылық константаларын пайдаланып табуға болады, онда:
СМ=[M]+β1∙[M]∙[L]+β1,2[M]∙[L]2+…β1,n[M]∙[L]n=
=M(1+β1∙[L]+β1,2∙[L]2+…β1,n ∙[L]n);
 N – максималды координациялық сан. Функция F(L) кез-келген комплексті бөлшектердің мольдік үлесін табуға пайдаланылады:
N – максималды координациялық сан. Функция F(L) кез-келген комплексті бөлшектердің мольдік үлесін табуға пайдаланылады:
αMLn = βn ∙ [L]n / F(L)
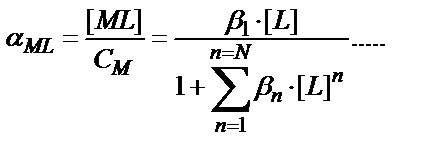
 (7.8)
(7.8)
Мольдік үлестердің қоспасы бірге тең. Мысалы, Ag++NH3↔Ag(NH3)+ :

Ag++2NH3↔[Ag(NH3)2]+

CAg+=[Ag+]+[Ag(NH3)+]+[Ag(NH3)2+]=[Ag+]+β1∙[Ag+]∙[NH3]+β1,2∙[Ag+]∙[NH3]2= [Ag+] (1+ β1∙[NH3]+β1,2∙[NH3]2)

 (7.9)
(7.9)
 (7.10)
(7.10)
 (7.11)
(7.11)
Құрамында 0,01М Ag+ және 1М NH3 бар ерітіндідегі комплекстік бөлшектердің тепе-теңдік концентрациясын есептейік. Есепті жеңілдету үшін ерітіндіде лигандтың көп артық мөлшері жүргенде бос лигандтың тепе-теңдік концентрациясын оның алғашқы концентрациясына тең деп алады. Сондықтан [NH3]= CNH3=1M.
(7.9) - теңдіктен:
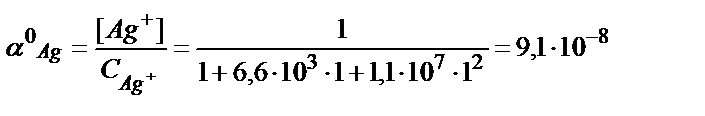
(7.10) - теңдіктен:

(7.11) - теңдіктен:

Енді комплекстік бөлшектердің тепе-теңдік концентрациясын (моль/л) табуға болады. (3.10), (3.11) теңдіктерінен:
[Ag(NH3)+] = CAg+ ∙ α ([Ag(NH3)]+)=0,01∙6∙10-4=6∙10-6 моль/л
|
|
|
[Ag(NH3)2+] = CAg+ ∙ α ([Ag(NH3)2]+)=0,01∙1,0=10-2 моль/л
Ерітіндіде тек [Ag(NH3)2]+ бөлшектері жүреді десе де болады, себебі оның концентрациясы [Ag(NH3)]+ бөлшектерінің концентрациясынан мың еседей артық.
Комплекстүзу процесін графикалық жолмен бейнелеу үшін жеке комплекстердің мольдік үлесінің лигандтың концентрациясына тәуелділігін қарастырады: α MLn – lg [L], не α MLn - pL(pL=-lg[L]). Ол үшін (7.8) теңдіктері бойынша лиганд концентрациясының өзгеруіне байланысты әр комплекстің мольдік үлесін есептейді.
7.1 суретте сынаптың (ІІ) хлоридті комплекстерінің таралу, не тепе-теңдік диаграммасы келтірілген. Ерітіндідегі сынаптың хлоридті комплекстері HgCl+, HgCl2, HgCl3-, HgCl42-, олардың тұрақтылық константалары β(HgCl+)=5,5∙106; β(HgCl2)=1,6∙101; β(HgCl3-) = 1,2∙1014; β(HgCl42-) = 1,2∙1015.
Әр комплекстің мольдік үлесі:


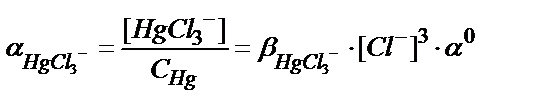


7.1 суреттен хлор иондарының концентрациясы өзгеруіне байланысты ерітіндіде басым жүретін негізгі комплекс HgCl2 екенін байқауға болады.
| 0,2 |
| 0,4 |
| 0,6 |
| 0,8 |
| 10-1 -3 р[L] |
| α |
| Нg2+ |
| HgCl42- |
| НgCl2- |
| НgCl3 - |
| HgCl+ |
Комплексті қосылыс ерітіндісіндегі тепе-теңдікті комплекстің диссоциациялануы тұрғысында қарастыруға болады:
MLn↔M+nL,  – тұрақсыздық константасы.
– тұрақсыздық константасы.
Тұрақсыздық константасы тұрақтылық константаға кері мән: 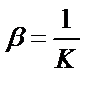 ;
;
Комплекс түзетін М және L компоненттердің тек өзара әрекеттесуі тәжірибеде өте сирек кездеседі. Көбінесе ерітіндіде М және L –мен қосымша реакцияға қатысатын заттар жүреді. Мысалы, сулы ерітіндінің қышқылдығы металл иондарының гидроксокомплекс, ал лигандтардың протонданған қосылыстар түзуіне себеп болады:
М+ nOH- ↔ M(OH)n (7.12)
L+mH3O+↔HmL+mH2O (7.13)
(7.12), (7.13) реакциялары жүйедегі М және L концентрацияларына әсер етіп негізгі (7.2) процесінің жүру жағдайын өзгертеді. Ерітіндіде жүретін қосымша реакцияларды ескеру үшін шартты тұрақтылық константаларын пайдаланған жөн:
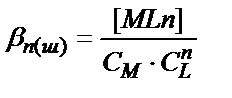 (7.14)
(7.14)
СМ – құрамында М бар бөлшектердің концентрациясы. Бұл мәнге негізгі лиганд L- мен байланысқан бөлшектер кірмейді:
СМ= [M]+[M(OH)]+[M(OH)2]+….[M(OH)n] (7.15)
Сол сияқты СL – М-мен байланысқан түрлеріне басқа құрамында L бар қосылыстардың қоспасы:
СL= [L]+[HL]+[H2L]+….[HmL] (7.16)
(7.15), (7.16) теңдіктерінде бөлшектердің зарядтары жазылмаған.
Шартты тұрақтылық константасын есептеу үшін қосымша реакциялардың коэффициенттерін білу керек – αМ, αL:
 ;
;  (7.17)
(7.17)
(7.14) теңдігіндегі СМ және CL мәндерін (7.17) мәндерімен алмастырса:
 (7.18)
(7.18)
αМ, αL- М және L бөлшектерінің белгілі жағдайдағы мольдік үлесін көрсетеді.
ΑМ және αL коэффициенттерін есептеуді қарастырайық. (7.15) теңдігіне кіретін МОН, М(ОН)2 т.б. бөлшектерінің концентрацияларын әр комплекске сәйкес тұрақтылық константаларын пайдаланып табуға болады:
β1= [MOH]/[M]∙[OH]; [M(OH)]= β1∙[M] ∙[OH]
β2= M(OH)2/[M]∙[OH]2; [M(OH)2]= β2∙[M]∙ [OH]2
………………………………………………………………..
Βn= [M(OH)n] / [M]∙[OH]n [M(OH)n]= βn[M]∙[OH]n (7.19)
Осыдан:
См=[M]+β1∙[M]∙[OH]+β1/2∙[M]∙[OH]2+…β1/n[M]∙[OH]n=
=[M]∙(1+β1∙[OH]+β1/2∙[OH]2+… β1/n∙[OH]n)
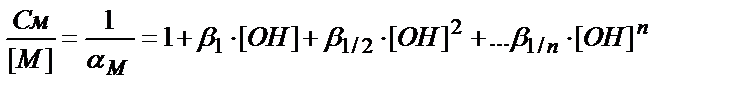
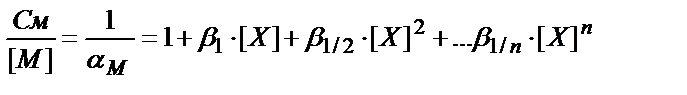 (7.20)
(7.20)
Егер МХ, МХ2 т.б. комплекстерінің тұрақтылық константалары және лиганд Х-тің концентрациясы белгілі болса αм мәнін жеңіл есептеуге болады. Сол сияқты αL да есептеуге болады. Пайда болатын қышқылдың жалпы формуласын Н4L дейік, онда НL, Н2L, H3L, H4L бөлшектерінің концентрациялары әрқайсысына сәйкес сатылай қышқылдық константалармен анықталады:
Н4L ↔ H3L- + Н+ 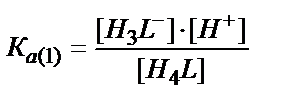
H3L- ↔ H2L2- + Н+ 
H2L2-↔ HL3- + Н+ 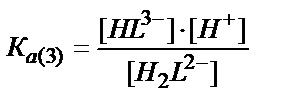
HL3- ↔ L4- + Н+ 
[HL3-] ↔ [L4-] ∙ [Н+] /KA(4)
[H2L2-]↔ [HL3- ]∙[Н+] /KA(3)
[H3L-] ↔ [H2L2-] + [Н+] /KA(2) (7.21)
[Н4L] ↔ [H3L-]+[Н+] /KA(1)
(7.21) теңдігіне [HL3-] мәнін қойсақ:
[H2L2-]=[L4-] ∙ [Н+]2/ KA(3)∙KA(4) (7.22)
(7.22) теңдігіне [H2L2-] мәнін қойсақ:
[H3L-]=[L4-] ∙ [Н+]3/ KA(4)∙KA(3)∙KA(2) (7.23)
(7.23) теңдігіне [H3L-] мәнін қойсақ:
[H4L]=[L4-] ∙ [Н+]4/ KA(1)∙KA(2)∙KA(3)∙ KA(1) (7.24)
(7.21-7.24) теңдіктеріндегі [HL3-], [H2L2-], [H3L-], [Н4L] мәндерін (7.16) теңдігіне қойсақ:
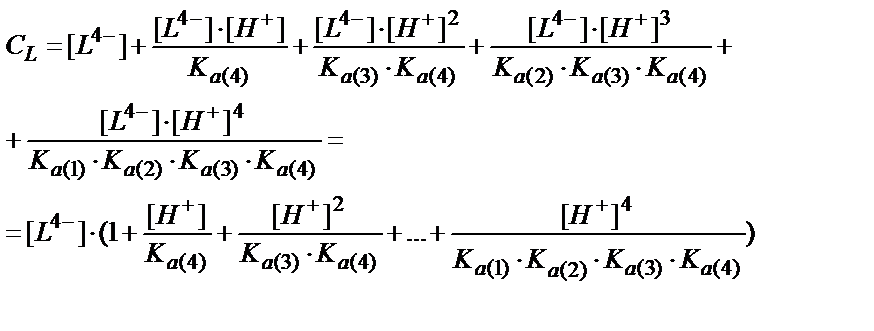

Мысалы, мыс иондарының этилендиаминтетрасірке қышқылымен (ЭДТУ) ерітінді рН=3 болғандағы түзетін комплекстің шартты тұрақтылық константасын табайық, ЭДТУ төрт негізді қышқыл (Н4У):

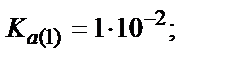
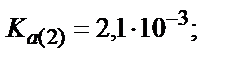


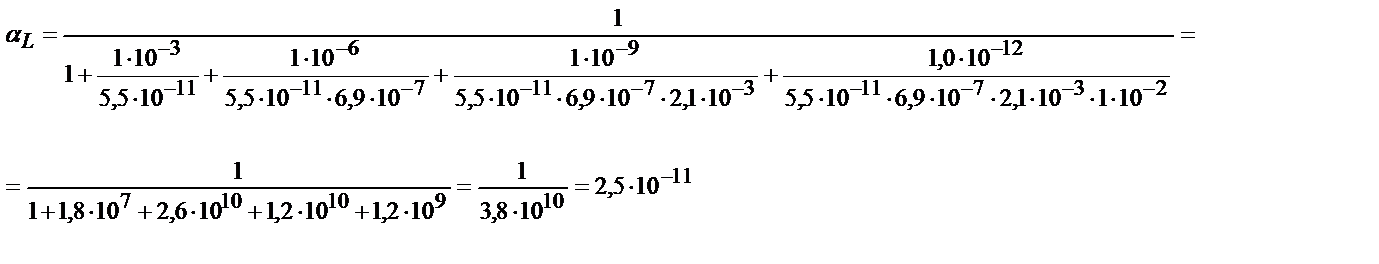
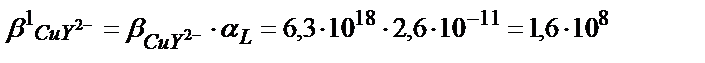
Комплекстің тұрақтылығы 1010 есе кемиді.
Егер М мен L екеуі де қосымша реакцияға қатысса β1 (7.18) теңдігімен есептеледі. Мысалы, 1,0 ∙10-3 М НСl ерітіндісіндегі HgY2- комплексінің тұрақтылық константасын табайық. Бұл жағдайда екі түрлі (бәсекелес) реакция жүреді: 1) Hg(II)-ионының хлоридті комплекстер түзуі; 2)Y4--ионының протондану реакциялары.
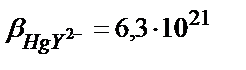 , сынаптың (ІІ) хлоридті комплекстерінің тұрақтылық константалары: β1= 5∙106; β2= 1,6∙1013; β3= 1,2∙1014; β4= 1,2∙1015.
, сынаптың (ІІ) хлоридті комплекстерінің тұрақтылық константалары: β1= 5∙106; β2= 1,6∙1013; β3= 1,2∙1014; β4= 1,2∙1015.
 αL мәні бұдан бұрынғы келтірілген мысалдардан 2,6∙10-11.
αL мәні бұдан бұрынғы келтірілген мысалдардан 2,6∙10-11.
(7.20) теңдігінен

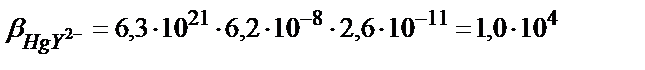
Келтірілген мысалдардан комплексті қосылыс алу үшін ерітіндідегі қосымша реакцияларды еске алып белгілі жағдайлар жасау қажет.
Тұрақтылық константаларын табуға, тәжірибелік мәндерді пайдаланып жеңіл есептелетін және тұрақтылық константаларымен күрделі математикалық байланысы бар функциялар пайдаланылады. Мұның бірі Бьеррум ұсынған «түзілу функциясы»  .
.  - комплекс түзгішпен байланысқан лигандтардың орта саны:
- комплекс түзгішпен байланысқан лигандтардың орта саны:

Лигандтардың жалпы концентрациясы СL бос лиганд пен жеке комплекстердің лигандтың санына көбейтілген концентрацияларының қосындысына тең:
CL= [ML]+2[ML2]+3[ML3]+….+n[MLn]+[L]
CL-[L] = [ML]+2[ML2]+ 3[ML3]+….+n[MLn];
(CL-[L]) – комплекстүзгішпен байланысқан лигандтардың концентрациясы. Бұл теңдікке кіретін комплекстердің концентрациясын толық тұрақтылық константаларын (7.6) пайдаланып табады:
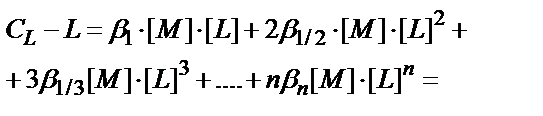
 (7.25)
(7.25)
Комплекстүзгіштің жалпы концентрациясы
См= [M]+[ML] + [ML2] + [ML3] + ….+[MLn];
(7.6) теңдігінен:
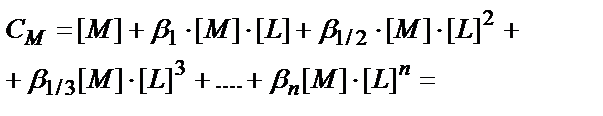
 (7.26)
(7.26)
(7.25) теңдігінің (7.26) теңдігіне қатынасы түзілу функциясы мен бос лигандтардың арасындағы байланысты береді:
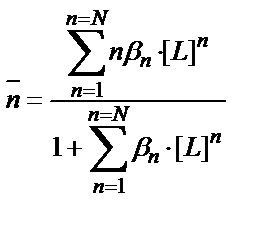
Бос лигандтың концентрациясының өзгеруі түзілу функциясы мәнін өзгертеді.
7.3.Ерітіндідегі комплекс түзу реакцияларының жылдамдығы
Реагенттердің концентрациясына, температураға, еріткішке және жүйенің жеке қасиеттеріне байланысты комплекс түзу реакцияларының жылдамдықтары өзгеріп тұрады. Бейорганикалық және органикалық лигандтары бар комплекстердің көпшілігінің түзілу және диссациациялану реакциялары өте тез жүреді. Бұндай комплекстер лабильді комплекстер деп аталады. Лабильді комплекстің мысалы ретінде мыстың тетрааминді комплексін Cu(NH3)42+ айтуға болады. Бұл комплекс мыс тұзының ерітіндісіне аммиак ерітіндісін қосқанда өте тез түзіледі де, ал ерітіндінің қышқылдығын арттырғанда тез бұзылады.
Ішкі сфералары өте бояу реакцияласатын немесе мүлдем реакцияласпайтын комплексті қосылыстарды инертті комплекстер деп атайды. Оларға Co(NH3)63+ ; Fe(CN)63-; және т.б. қышқылдығы өте жоғары ерітіндіде ыдырамайтын комплекстер жатады. Комплекстерді лабильді және инертті деп шартты түрде ғана бөледі, өйткені оларды бір-бірінен бөліп тастау негізсіз болады. Таубенің пікірі бойынша егер 0,1 М ерітіндідегі комплекс қатысында жүретін реакция бөлме температурасында 1мин ішінде өтетін болса, ондай комплекс лабильді болады. Дегенмен бұндай критерий еркін болып қалады.
Бақылау сұрақтары мен жаттығулар
1. Комплексті қосылыс деген не?
2. Координациялық сан, дентанттық деген не? Бір және көпдентатты комплекстерге мысал келтіріңдер.
3. Комплексті қосылыстардың тұрақтылығына қандай факторлар әсер етеді?
4. Комплексті қосылыстардың жалпы және сатылай түзілу константалары бір-бірімен қандай байланыста болады?
5. Комплекстену функциясы деген не? Осы функцияны пайдаланып қандай есептеулер жүргізуге болады?
6. Комплексті қосылыс түзілу реакцияларының аналитикалық химияда қолданылуына мысал келтіріңдер.
1. Комплексті [Ag(CN)2]-ионының сатылай тұрақсыздық константалары (К) мен тұрақтылық (β) константалары арасындағы тәуелділік мына теңдеулермен анықталады:
1) 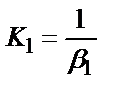
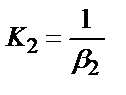
 ;
;
2) 

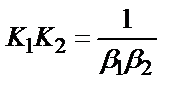 ;
;
3) 
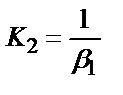
 ;
;
4) 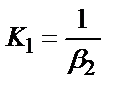

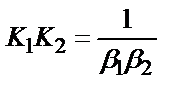 ;
;
5) дұрыс жауап берілмеген.
2. Күміс иондарының аммиакпен комплекс түзуінің комплекстену функциясын (F(L)= Ф) қайсы теңдеумен есептеуге болады?
1) 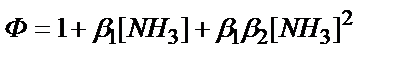 ;
;
2) 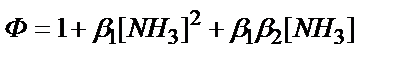 ;
;
3) 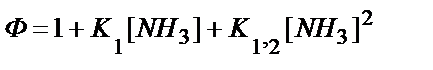 ;
;
4)  ;
;
5) 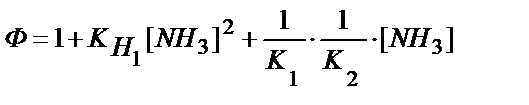 .
.
3. Мына реакциялар бойынша: Ag++CN-↔[Ag(CN)] (1); [Ag(CN)]+CN- ↔[Ag(CN)2]- (2) комплекс түзілу тепе-теңдігінің жалпы термодинамикалық константасы мына теңдеумен анықталады:
1)  ; 2)
; 2)  ;
;
3) 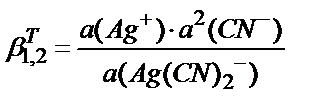 ; 4)
; 4)  ;
;
5) 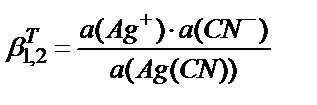 .
.
4. [Ag(NH3)2]+комплексті ионының сатылай тұрақтылық және тұрақсыздық константалары арасындағы тәуелділігі мына теңдеулермен анықталады:
1) 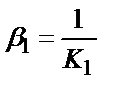 ,
,  ,
,  ;
;
2)  ,
,  ,
,  ;
;
3)  ,
,  ,
,  ;
;
4)  ,
,  ,
,  ;
;
5) дұрыс жауап берілмеген;
5. Комплексті ионның диссоциациялану процесінің жеке сатыларын сипаттайтын константалар (К) мен оның жалпы тұрақтылық константасы (βn) арасында қандай арақатынас бар?
1) βn= K1+ K2+... Kn;
2) βn= K1x Kn;
3) βn= 1/K1 . K2...KN;
4) βn= K1x K2... Kn;
5) βn= (K1+ K2... +Kn) / K1x K2... .Kn.
6. [Ag(NH3)2]+комплексті ионын бұзу үшін төменде көрсетілген қандай қосылысты пайдаланған ең тиімді?
1) NaCl ЕКAgCl= 1,6 х 10-10;
2) NaBr ЕКAgBr= 7,0 х 10-13;
3) NaJ ЕКAgJ= 1,0 х 10-16;
4) NaSCN ЕКAgSCN= 1,0 х 10-12;
5) NaOH ЕКAgOH= 2,0 х 10-8.
7. Төменде көрсетілген 0,1 M комплексті тұздар ерітінділерінің қайсысында Cd2+ ионының концентрациясы ең жоғары болады?
1) [Cd(CN)4]2- Kт= 7,8 х 10-18;
2) [Cd(NH3)4]2+ Kт= 2,8 х 10-7;
3) [CdCl4]2- Kт= 2,0 х 10-2;
4) [CdJ4]2- Kт= 3,8 х 10-6;
5) [Cd(N2H4)4]2- Kт= 1,3 х 10-4.
8. Өте сұйытылған [Ag(NH3)2]NO3ерітіндісіне мына тұздарды қосқанда кандай тұнба алдымен түзіледі?
1). KBrO3 ЕК (AgBrO3) = 5,5 х 10-5;
2) KCl ЕК (AgCl) = 1,6 х 10-10;
3) KBr ЕК (AgBr) = 7,0 х 10-13;
4) K2S ЕК (Ag2S) = 6,3 х 10-50;
5) тұнба түзілмейді.
9. Аммиакаттарды бұзуға жалпы комплекстерді ыдырату тәсілінің қайсысын қолдану тиімді?
1) сұйылту; 2) қыздыру; 3) қышқылдау; 4) тотықтыру;
5) тотықсыздандыру.
10. Тиосульфаттарды бұзуға жалпы комплекстерді ыдырату тәсілінің қайсысын қолдану тиімді?
1) сұйылту; 2) қыздыру; 3) қышқылдау;
4) сілтілеу; 5) күшті электролит қосу.
11. Сулы ерітінділерде комплексті тұздардың диссоциациясы былай сипатталады:
1) комплексті тұздар күшті электролиттерше диссоциацияланады;
2) комплексті тұздар электролиттік диссоциациялану процесінің бірінші сатысында әлсіз электролиттерше, ал комплексті иондардың өзі күшті электролиттерше диссоциацияланады;
3) комплексті тұздар әлсіз электролиттерше диссоциацияланады;
4) комплексті тұздар электролиттік диссоциациялану процесінің бірінші сатысында күшті электролиттерше, ал комплексті иондардың өзі әлсіз электролиттер сияқты диссоциацияланады;
5) комплексті тұздар бірінші және екінші сатылар бойынша да әлсіз электролиттерше диссоциацияланады.
12. Комплексті иондарда орталық атом мен лигандалар арасында қандай байланыс болмайды?
1) иондық;
2)ковалентті;
3)электровалентті;
4) донорлы-акцепторлық;
5)сутекті.
13. Комплексті ионның электролиттік диссоциациясы комплекстеуші лигандтың артық мөлшерін қосқанда:
1) төмендейді; 2) төмендейді, одан кейін жоғарлайды;
3) жоғарлайды; 4) жоғарлайды, одан кейін төмендейді;
5) өзгермейді.
14. Мына реакциялар қатарының қайсысы жүруі мүмкін:
1) Ag+ → AgJ → [Ag(CN)2]- → AgCl → [Ag(NH3)2]+ → Ag2S;
2) Ag+ → AgCl → [Ag(NH3)2]+ → Ag2S → [Ag(CN)2]- → AgJ;
3) Ag+ → AgCl → [Ag(CN)2]- → AgJ → [Ag(NH3)2]+ → Ag2S;
4) Ag+ → AgCl → [Ag(NH3)2]+ → AgJ → [Ag(CN)2]- → Ag2S;
5) Ag+ → Ag2S → [Ag(CN)2]- → AgCl → [Ag(NH3)2]+ → AgJ.
15. Күміс қосылыстарының қайсысы аммиак ерітіндісінде ең алдымен ериді?
1) AgCl EKAgCl= 1,6 х 10-10;
2) AgBr EKAgBr= 7,0 х 10-13;
3) AgJ EKAgJ= 1,0 х 10-16;
4) AgSCN EKAgSCN = 1,0 х 10-12;
5) Ag2S EKAg2S = 6,3 . 10-50.
16. MeLn комплексінің жалпы концентрациялық тұрақтылық константасының теңдеуін көрсетіңіз:
1)  ; 2)
; 2)  ; 3)
; 3)  ;
;
4) 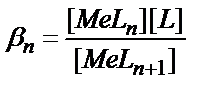 ; 5)
; 5)  .
.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3383; Нарушение авторских прав?; Мы поможем в написании вашей работы!