
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металлхромды индикаторлар
Тарау
комплексонометриялық титрлеу
8.1. Комплексонометриялық әдістің жалпы сипаттамасы
Комплексометриялық титреу әдісінде анықтайтын зат пен титрантың арасында жүретін комплекстік қосылыс түзілу реакциясы пайдаланылады. Бұл әдісте металл иондарын титрант ретінде лигандтарды алып титрлейді. Комплексометрия негізінен аналитикалық химияда ертеден пайдаланып келеді. Өткен ғасырдың ортасында Либих комплексометриялық жолмен CN- иондарын Ag+ иондары тұзымен титрлеу әдісін ұсынды:
2CN- + Ag+ ↔ [Ag(CN)2]- (8.1)
(8.1) реакция аяқталғаннан кейін әрмен қарай құйылған AgNO3 комплекстік анионмен қосылып тұнба береді:
[Ag(CN)2]- + Ag+ →Ag[Ag(CN)2]↓
Ертіндінің алғашқы лайлана басталғаны титрлеудің аяқталғанын көрсетеді.
Комплексометриялық титрлеудің тағы бір мысалы СІ-, Br-, иондарын сынап(ІІ) нитратымен титрлеу (меркуриметрия). Нg+2 иондарының координациялық саны екі не төртке тең, НgСІ2, НgBr2 сияқты өте тұрақты комплекстері пайда болады.
Меркуриметриялық әдісте эквивалентті нүктені анықтауға натрийдің нитропрусидін пайданалады – Na2[Fe(CN)5NO]. Бұл қосылыс эквивалентті нүктеде Нg2+ иондарымен ақ кристалды тұнба береді Нg[Fe(CN)5NO]↓. (ЕК= 1*10-9). Нитропруссид индикаторының бір артықшылығы – галоген иондарын тікелей күшті қышқыл ортада анықтауға болады. Бұл титрлеуде индикатор ретінде дифенилкарбазид және дифенилкарбазонды пайдалануға да болады. Нg2+ иондары бейтарап, не әлсіз қышқыл ортада дифенилкарбазидпен көк түсті қосылыс түзеді, ал дифенилкарбазонмен рН 1,5-2,0 тұсында өте жақсы нәтиже алынады.
Комплексометриялық әдісте де пайдаланатын реакциялар титриметриялық анализдегі реакцияларға қойылатын шарттарға жауап беруі керек. Соның ішінде бұл әдіс үшін ең маңыздысы – реакцияның нәтижесінде белгілі стехиометриялық құрамы бар қосылыс түзілуі.
Монодентатты лигандтары пайдаланғанда метал иондарының координациялық санына қарай «n» бірнеше комплекстік қосылыстар түзілуі мүмкін: ML1, ML2, ML3 ……MLn. Егер әр комплекске сәйкес сатылай тұрақтылық константаларының β1, β2...... βn бір бірінен айырмашылығы болмаса, онда ерітіндіге L лигандын қосқанда келтірілген қосылыстардың бәрі түзіледі. Тепе – теңдікті соңғы MLп комплексін алу жағына толық ығыстыру үшін лигандтың көп артық мөлшерін құю керек. Сондықтан бұндай реакциялады титриметриялық анализде пайдалануға болмайды.
Титриметриялық мүддеге пайдаланылатын комплекстердің құрамындағы лигандтардың саны аз бір, не екіге сәйкес болуы керек. Ол үшін полидентантты, құрамында комплекс түзушінің бар координациялық сферасын қанықтыратын донорлы топшалары бар лигандтарды пайдалануға болады.
Бейорганикалық лигандтар көбінесе монодентатты болғандықтан оларды комплексометриялық мақсатта сирек пайдаланады.
Жоғарыда келтірілгендей комплексометриялық титрлеу әдістері белгілі болғанымен бұл әдістің кең дамуы органикалық титранттарды, әсіресе 1945 ж. швейцар химигі Шварценбах ұсынған аминополикарбон қышқылдарын металл иондарын анықтауға пайдаланғаннан кейін басталды.
Аминополикарбон қышқылдары – комплексондар, ал оларды пайдаланып титрлеу комплексонометриялық титрлеу деп аталады. Комплексондардың ең қарапайым өкілдері: иминодисірке қышқылы - НN(CH2COOH)2, нитрилоүшсірке қышқылы - N(CH2COOH)3.
Комплексонометрияда кең қолдану тапқан қышқыл – этилендиаминтөртсірке қышқылы (ЭДТУ):
(НООСН2С)2N-СН2-СН2-N(СН2СООН)2 және оның екі натрийлі тұзы-ЭДТА, комплексон III, трилон Б ЭДТУ төрт карбоксил топшаларындағы төрт протонын беріп жібере алады, сондықтан оның формуласын қысқа түрде Н4У деп жазуға болады. Бұл қышқылдың судағы ерітіндісінде мынандай протолитикалық тепе –теңдіктер пайда болады:
Н4У+ Н2О  Н3У-+Н3О+, КА(1) =1,00*10-2 р КА(1) =2,00
Н3У-+Н3О+, КА(1) =1,00*10-2 р КА(1) =2,00
Н3У-+ Н2О  Н2У2-+Н3О+, КА(2) =2,16*10-3 р КА(2) =2,67
Н2У2-+Н3О+, КА(2) =2,16*10-3 р КА(2) =2,67
Н2У2-+ Н2О  НУ3-+Н3О+, КА(3) =6,92*10-4 р КА(3) =6,16
НУ3-+Н3О+, КА(3) =6,92*10-4 р КА(3) =6,16
НУ3-+ Н2О  У4-+Н3О+, КА(4) =6,92*10-4 р КА(4) =10,26
У4-+Н3О+, КА(4) =6,92*10-4 р КА(4) =10,26
р Ка(1),р Ка(2) мәндерінің бір-біріне ұқсастығы және олардың рКа(3) пен рКа(4) мәндерінен үлкен айырмашылығы қышқылдың бетаинды құрылысымен (қайта топтасуымен) анықталады:
| – OOCH2C CH2COOH NH – CH2 – CH2 – NH HOOCH2C CH2COO – |
| + |
| + |
Сондықтан ЭДТУ –дың формуласын былай жазуға болады Н2[Н2У], ал ЭДТА ның формуласын – Nа2Н2У. ЭДТУ –дың судағы ерітіндісінде рН 3-6 аралығында жүретін негізгі бөлшек Н2У2-, әлсіз негіздік ортада – НУ3-, ал рН>11 болғанда -толық протондарын берген ион У4- (8.1 – сурет). Бұл комплексондар –молекуласында бірнеше донорлы топшалар бар көпдентатты лигандтар. ЭДТА құрамында оттегі атомдарымен төрт донорлы топшалар –СОО- және азот атомдарымен екі донорлы топшалары бар, сондықтан ол координациялық саны 4 және 6 тең металл иондарының координациялық сферасын түгел толтырады, пайда болған комплекстің құрамы М:L=1:1.
|
8.1 – сурет. Этилендиаминтөртсірке қышқылы (Н4У) құрамының ерітінді рН –на тәуелділігі. (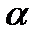 -әр жеке бөлшектердің сәйкес әлсіз қышқылдың жалпы концентрциясынан үлесі). -әр жеке бөлшектердің сәйкес әлсіз қышқылдың жалпы концентрциясынан үлесі).
|
Комплексті қосылыстың заряды комплекстүзгіштің зарядымен анықталады:
М2++Н2У2-  МУ2-+2Н+ (8.2)
МУ2-+2Н+ (8.2)
 М3++Н2У2-
М3++Н2У2-  МУ-+2Н+ (8.3)
МУ-+2Н+ (8.3)
 М4++Н2У2-
М4++Н2У2-  МУ+2Н+ (8.4)
МУ+2Н+ (8.4)
| O = C – O O – C = O H2C CH2 N N HOOCH2C CH2COOH H2C CH2 |
| M |
Үш зарядталған металл иондары М3+ тағы бір – СООН топшасымен сақина түзеді. Хелатты циклдердің саны артқан сайын комплексті қосылыстың тұрақтылығы да артады (8.1-кесте).
8.1 – кесте
Кейбір металл комплексонаттарының lg  мәндері
мәндері
| Мn+ | lg 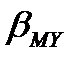
| Мn+ | lg 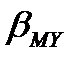
| Мn+ | lg 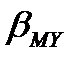
|
| Tl+ | 5.3 | Cd2+ | 16.5 | Ti3+ | 21.3 |
| Ag+ | 7.3 | Pb2+ | 18.0 | Tl3+ | 21.5 |
| Ba2+ | 7.8 | Ni2+ | 18.6 | Sc3+ | 23.1 |
| Sr2+ | 8.6 | Cu2+ | 18.8 | In3+ | 24.9 |
| Mg2+ | 8.7 | Hg2+ | 21.8 | Fe3+ | 25.1 |
| Ca2+ | 10.7 | La3+ | 15.5 | Bi3+ | 27.9 |
| Mn2+ | 13.8 | Ce3+ | 15.9 | Th4+ | 23.0 |
| Fe2+ | 14.3 | Al3+ | 16.1 | Ce4+ | 24.2 |
| Co2+ | 16.3 | Y3+ | 18.1 | U4+ | 25.2 |
| Zn2+ | 16.5 | Ya3+ | 20.3 | Zr4+ | 29.5 |
(8.2) – (8.4) реакциялардың теңдігінен әр металл иондары әрекеттескенде комплекстік қосылыс түзілумен қатар екі протон бөлініп шығады. Ерітіндінің қышқылдығын арттырмау үшін буферлі қоспалар пайдаланылады (аммиакты, тартратты, ацетатты, т.б.). Ерітінді рН-ның төмендеуі, әсіресе комплекстің тұрақтылығы аз болса, металл иондарының комплекске толық байланыспауына әкеп соғуы мүмкін. Пайдаланылатын буферлі қоспалар, мысалы аммиакты буфер, көптеген металл иондарымен аммиакты комплекстер түзеді-MLn(L-NH3). MLn комплекстері сәйкес комплексонаттарға қараған-да тұрақсыз болғанымен, олардың түзілуін комплексонаттардың тұрақтылы-ғын бағалағанда еске алу керек. Бұл жағдайда тұрақтылықты бағалайтын мән термодинамикалық тұрақтылық константасы 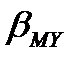 емес, шартты тұрақтылық константасының мәні
емес, шартты тұрақтылық константасының мәні 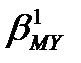 ;
;
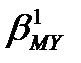 =
= 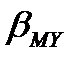 *
*  , не lg
, не lg 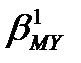 =lg
=lg 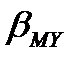 +lg
+lg  (8.5)
(8.5)
Сонымен қатар ерітіндіде жүретін бәсекелесті У4- иондарының протондану реакциясын да еске алу керек. Ол үшін комплекстің шартты тұрақтылық константасының теңдігіне 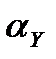 -коэффициентін енгізеді:
-коэффициентін енгізеді:
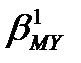 =
= 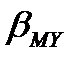 *
*  *
* 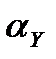 , не lg
, не lg 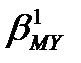 =lg
=lg 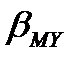 +lg
+lg  + lg
+ lg 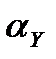 , (8.6)
, (8.6)
Белгілі рН-қа сәйкес 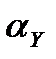 коэффициентінің мәнін (8.7) -теңдігін пайдаланып табуға болады:
коэффициентінің мәнін (8.7) -теңдігін пайдаланып табуға болады:
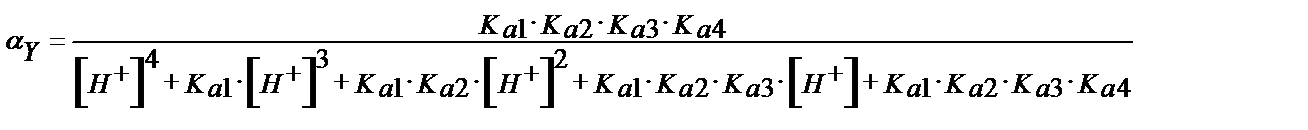 (8.7)
(8.7)
8.2-кесте
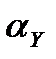 коэффицентінің ерітінді рН –на байланысты мәндері
коэффицентінің ерітінді рН –на байланысты мәндері
| рН | 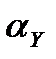
| lg 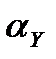
| рН | 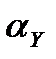
| lg 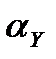
|
| 3,7*10-14 | -13,4 | 5,4*10-3 | -2,3 | ||
| 2,5*10-11 | -10,6 | 5,2*10-2 | -1,3 | ||
| 3,6*10-9 | -8,5 | 3,5*10-1 | -0,46 | ||
| 3,5*10-7 | -6,5 | 8,5*10-1 | -0,07 | ||
| 2,2*10-5 | -4,7 | 9,8*10-1 | -0,01 | ||
| 4,8*10-4 | -3,3 |
8.2 – кестетегі мәліметтер қышқыл ортада 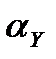 мәні өте төмендейтінін көрсетеді, осыған байланысты тұрақтылығы аз комплексонаттарға сәйкес
мәні өте төмендейтінін көрсетеді, осыған байланысты тұрақтылығы аз комплексонаттарға сәйкес 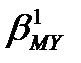 мәні де азайып, металл иондары тіпті ЭДТА – мен байланспауы да мүмкін. Екінші жағынан, өте тұрақты комплекс түзетін үш зарятталған иондардың комплексонаттары қышқыл ортада да алынады. Осы себепті Са2+, Mg2+, Sr2+ иондарын ЭДТА –мен негіздік ортада, ал Bi3+, Fe3+ иондарын қышқылдық ортада титрлейді.
мәні де азайып, металл иондары тіпті ЭДТА – мен байланспауы да мүмкін. Екінші жағынан, өте тұрақты комплекс түзетін үш зарятталған иондардың комплексонаттары қышқыл ортада да алынады. Осы себепті Са2+, Mg2+, Sr2+ иондарын ЭДТА –мен негіздік ортада, ал Bi3+, Fe3+ иондарын қышқылдық ортада титрлейді.
Комплексонометриялық титрлеуді нәтижелі жүргізу үшін 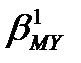 мәні ең кем дегенде 107 сәйкес, не одан көп болуы керек.
мәні ең кем дегенде 107 сәйкес, не одан көп болуы керек.
Мысалы, келтірілген жағдайларда төмендегі иондарды ЭДТА –мен титрлеуге бола ма?
а) СаУ2-, рН 5 болғанда;
б) ҒеУ-, рН 2 болғанда;
в) ZnУ2-, концентрациясы 5,5·10-2М аммиак ерітіндісінде, мырыштың аммиакатты комплекстерінің тұрақтылық константалары:
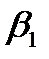 =2.0·102;
=2.0·102; 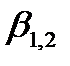 =4.1·104;
=4.1·104;  =1.0·107;
=1.0·107;  =1.3·109; K в (NH
=1.3·109; K в (NH 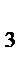 )=1.8·10-5
)=1.8·10-5
Бұл сұраққа жауап беру үшін келтірілген комплексонаттардың шартты тұрақтылық константаларын тауып алу керек:
а) 8.1 және 8.2 кестелерден lg 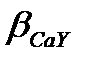 =10.7, lg
=10.7, lg 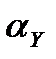 =-6.5, lg
=-6.5, lg  =10.7-6.5=4.2,
=10.7-6.5=4.2,  =1.6·104<107, демек Са2+ иондарын рН=5 –те комплексонометриялық әдіспен титрлеуге болмайды.
=1.6·104<107, демек Са2+ иондарын рН=5 –те комплексонометриялық әдіспен титрлеуге болмайды.
б) lg 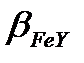 =25.1; lg
=25.1; lg 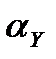 =-13.4; lg
=-13.4; lg 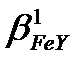 =25.1-13.4=11.6;
=25.1-13.4=11.6; 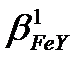 =4.0·1011>107, демек Ғе3+ иондарын ерітіндінің рН=2 болғанда комплексонометриялық жолмен титрлеуге болады.
=4.0·1011>107, демек Ғе3+ иондарын ерітіндінің рН=2 болғанда комплексонометриялық жолмен титрлеуге болады.
в) lg  =16.5;
=16.5;
I/ 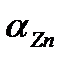 =1+2.0·102·5.5·10-2+4.0·104·(5.5·10-2)2+1.0·107·(5.5·10-2)3+ +1.3·109·(5.5·10-2)4= =1.35·104, lg
=1+2.0·102·5.5·10-2+4.0·104·(5.5·10-2)2+1.0·107·(5.5·10-2)3+ +1.3·109·(5.5·10-2)4= =1.35·104, lg  =-4.1;
=-4.1;
[OH-]= 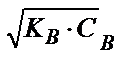 =
= 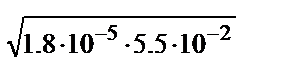 =1.0·10-3, рОН=3, рН=11.
=1.0·10-3, рОН=3, рН=11. 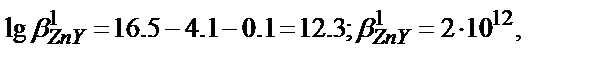 демек бұл жағдайда Zn2+ иондарын комплексонометриялық әдіспен титрлеуге болады.
демек бұл жағдайда Zn2+ иондарын комплексонометриялық әдіспен титрлеуге болады.
8.2. Титрлеу қисықтары
Күшті сілтілі ортада (рН  11) көп зарятталған металл ионын ЭДТА –мен титрлеуді қарастырайық. Ерітіндінің рН
11) көп зарятталған металл ионын ЭДТА –мен титрлеуді қарастырайық. Ерітіндінің рН  11 сәйкес болғанда ЭДТА тек У4- иондары түрінде жүреді. Есептеуді жеңілдету үшін иондардың зарядтарын еске алмайық Mn++ У4-
11 сәйкес болғанда ЭДТА тек У4- иондары түрінде жүреді. Есептеуді жеңілдету үшін иондардың зарядтарын еске алмайық Mn++ У4-  MУ(4-)+(n+) онда комплекстік қосылыс түзілу реакциясы былай жазылады:
MУ(4-)+(n+) онда комплекстік қосылыс түзілу реакциясы былай жазылады:
М+У  МУ (8.8)
МУ (8.8)
ал МУ тұрақтылық константасы:
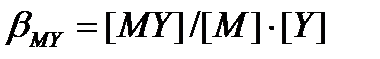 (8.9)
(8.9)
Комплексонометриялық титрлеу қисығы рМ мәні мен қосылған титранттың көлемінің арасындағы байланысты көрсетеді. Эквивалентті нүктеге дейін металл иондарының концентрациясы реакцияласпай қалған металл иондарына сәйкес болады, сондықтан:
[M]=(СM·VM-СY·VY)/ (VM+VY) (8.10)
Эквиваленттік нүктеде бар металл иондары комплекстік қосылысқа МУ айналады, сондықтан олардың концентрациясы (8.8) теңдіктегі тепе-теңдікпен анықталады [M]=[Y]
(8.9) теңдіктен  =[MY]/[M]2, [M]2=[MY]/
=[MY]/[M]2, [M]2=[MY]/  , [M]=
, [M]= 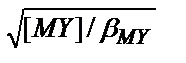 , lg[M]=
, lg[M]= 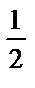 (lg[MY]-lg
(lg[MY]-lg  ), не рМ=
), не рМ=  ·(рМУ+ lg
·(рМУ+ lg  ).
).
Эквивалентті нүктеден кейін рМ мәні тағы (8.9) теңдікпен есептелінеді:
[M]=[МY]/ 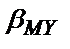 · [Y], не логарифмдегеннен кейін
· [Y], не логарифмдегеннен кейін
lg[M]=lg[MY]-(lg  +lg[Y]); pM=pMY+lg
+lg[Y]); pM=pMY+lg  -pY (8.11)
-pY (8.11)
рУ мәні артық құйылған комплексонның концентрациясымен анықталады:
[У]=(СУ·VУ-СМ·VМ)/ (VУ+VМ) (8.12)
егер ерітіндіде басқа комплекс түзгіш болса (мысалы, буферлі қоспаның бір компоненті), не титрлеуді рН<11 жағдайында жүргізсе, құрамында тұрақтылық константасы  бар теңдіктерде
бар теңдіктерде 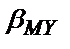 -дің орнына шартты тұрақтылық константасын қою керек:
-дің орнына шартты тұрақтылық константасын қою керек: 
Мысал ретінде 50,00 мл 0,010 М Са2+ ерітіндісін 0,010М Са2+ ЭДТА (У) –мен титрлеу қисығын қорытып шығарайық, ерітіндінің рН=10. 8.1 және 8.2 кестелерден рН=10 болғанда 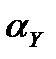 = 3,5·10-1, ал
= 3,5·10-1, ал 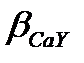 =3,9·1010. Осыдан
=3,9·1010. Осыдан
 =
= 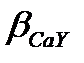 ·
· 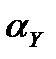 =3,9·1010·3,5·10-1=1,36·1010.
=3,9·1010·3,5·10-1=1,36·1010.
1. Эквивалентті нүктеге дейін: 50,00 мл 0,010 М Са2+ ерітіндісіне 45,00 мл 0,010М У қосса:
[Ca2+]=(50,00×0,01-45,00×0,01)/96,00=5,3×10-4моль/л.
2. Эквиволентті нүктеде тек СаУ комплексі жүреді, сондықтан оның концентрациясы ерітіндінің сұйытылғанын еске алмаса (50,00 мл 0,010 М Са2++50,00 мл 0,010 М У  50,00 мл 0,010 М СаУ) 0,010 М сәйкес, ал 100
50,00 мл 0,010 М СаУ) 0,010 М сәйкес, ал 100 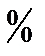 сұйылатынын еске алса – 50,00·0,010/100= 0,005М.
сұйылатынын еске алса – 50,00·0,010/100= 0,005М.
 =[CaУ]/[Ca2+]·Cу; [Ca2+]=Cу
=[CaУ]/[Ca2+]·Cу; [Ca2+]=Cу
[Ca2+]= 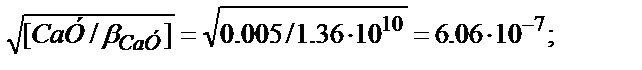 pCa=6.22
pCa=6.22
3. Эквиваентті нүктеден кейін: 50,00 мл 0,010М Са2+ ерітіндісіне 70,00 мл 0,010М У қосса 50,00 мл 0,010М СаУ пайда болады да, 20,00 мл 0,010М У артық қалады. Ерітіндінің сұйытылғанын еске алсақ:
[Ca]=(50.00·0.010)/120=4.17·10-3
CY =(70.00·0.010-50.00·0.010)/120=20·0.010/120=1.67·10-3 М.
 =[CaУ]/[Ca2+]·CY; [Ca2+]=[CaУ]/
=[CaУ]/[Ca2+]·CY; [Ca2+]=[CaУ]/  ·CY=4.17·10-3/1.36·1010· 1.67·10- 3=1.84·10-10; pCa=9.74
·CY=4.17·10-3/1.36·1010· 1.67·10- 3=1.84·10-10; pCa=9.74
| 20 40 60 80 100 |
| pCa |
| V |
8.2 – сурет. 50,00 мл 0,010М Са2+
тұзының ерітіндісін 0,010М ЭДТА
ерітіндісімен комплексонометриялық
титрлеу қисығы. 1-рН=10; 2-рН =5.
Титрлеу қисығының эквивалентті бөлігінің биіктігі анықтайтын компонент пен титрант концентрациясына байланысты. Концентрация артқан сайын эквивалентті бөлігі де артады (8.2-сурет). Сонымен қатар эквивалентті бөліктің биіктігі тұрақтылық константасының мәніне де байланысты: тұрақтылық константасы артса эквивалентті бөліктің биіктігі артады. Егер титрлейтін ерітіндіде металл иондарымен әрекеттесетін басқа лиганд болса, не ерітіндінің рН<11 болса, 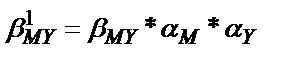 ;
; 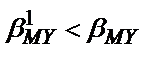 болғандықтан, титрлеу қисығының эквивалентті бөлігі кішірейіп, кей жағдайда титрлеуге мүмкіншілік болмай қалады (8.2 -сурет, 2 -қисық).
болғандықтан, титрлеу қисығының эквивалентті бөлігі кішірейіп, кей жағдайда титрлеуге мүмкіншілік болмай қалады (8.2 -сурет, 2 -қисық).
Металлхромды индикаторлар – металл иондарымен әртүрлі боялған комплекстер түзетін әлсіз протолиттік қасиеті бар органикалық бояғыштар. Бос индикаторлар мен олардың комплекстерінің түсі әртүрлі және бұл комплекстердің тұрақтылығы сәйкес комплексонаттардың тұрақтылығынан кем болуы керек. Сондықтан металл иондарын индикатордың қатысында комплексонмен титрлегенде алдымен бос металл иондары титрленеді М+У  МУ, олар түгел комплекстік қосылысқа айналғаннан кейін комплексонның келесі құйған мөлшері
МУ, олар түгел комплекстік қосылысқа айналғаннан кейін комплексонның келесі құйған мөлшері 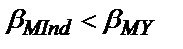 болғандықтан «металл – индикатор» комплексімен әрекеттеседі: MInd+Y
болғандықтан «металл – индикатор» комплексімен әрекеттеседі: MInd+Y  MY+Ind. Екінші реакция аяғына шейін жүргенде ерітінді бос индикатордың түсіне боялады. Алғашқыда ерітіндінің түсі «металл-индикатор» комплексінің түсіне сәйкес.
MY+Ind. Екінші реакция аяғына шейін жүргенде ерітінді бос индикатордың түсіне боялады. Алғашқыда ерітіндінің түсі «металл-индикатор» комплексінің түсіне сәйкес.
Металлхромды индикаторлардың комплексі тұрақтылық константалармен сипатталады. Зарядтарды еске алмаса:
Ind+М  MInd; bMInd = [MInd]/[Ind]·[M] (8.13)
MInd; bMInd = [MInd]/[Ind]·[M] (8.13)
Сонымен қатар, бұл комплекс индикатордың түсін өзгерту аралығы және нүктесімен сипатталады. Ерітіндінің түсі айқын өзгеруіне сәйкес индикатордың комплекстен бос күйіне ауысу нүктесі индикатордың комплексі мен иондарының концентрациясы теңескенде байқалады: [MInd] =[Ind], бұл жағдайда (8.13) теңдіктен:
[M]T=[MInd]/ bMInd·[Ind]= 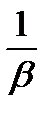
-lg[M]T=pMT=lgbMInd (8.14)
Олай болса индикатордың түсі ауысу нүктесінде (титрлеудің соңғы нүктесі) pMT=lgbMind.
Индикатордың түсін ауыстыру аралығы оның екі түрінің концентрацияларының қатынасымен анықталады, ол қатынас [MInd]/[Ind] 1/10 –нан 10/1 –ге дейін өзгереді:
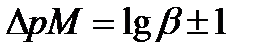 (8.15)
(8.15)
Комплексонометриялық титрлеуге индикаторларды таңдағанда олардың түсін өзгерту аралығы титрлеу қисығының эквивалентті бөліміне сәйкес болуы керек.
Металлхромды индикаторлар – көппротонды қышқылдар, мысалы:
1) эриохром қара Т-үш негізді әлсіз қышқыл H3Jnd
Судағы ерітіндіде рН<6 сульфотопшанның протоны ионизацияланған, сондықтан индикатор қызыл түсті H2Jnd- түрінде жүреді.
рН>7болғанда индикатордың басым түрі көк түсті HJnd2-
H2Jnd- «HJnd2-, ал рН>12 – сары түсті ион Jnd3-. ℓgК(HJnd2-) = 11,5, ℓgК(H2Jnd-) = 6,3.
Индикатордың металл иондармен беретін комплексінің түсі қызыл, сондықтан эквивалентті нүктеде ерітіндінің түсі айқын өзгеруі үшін (қызыл®көк), титрлеуді әлсіз сілтілік ортада жүргізу керек (рН 7 мен 11 аралығы). Бұл индикаторды пайдаланып Mg2+, Ba2+, Cd2+, Pb2+, Zn2+, Mn2+, Sr2+ иондарын комплексонометриалық әдіспен анықтауға болады. Титрлеуді аммиакты буферлі қоспа (рН 9-10) қатысында жүргізеді:
М2+ + HJnd2- «MJnd- + Н+
көк қызыл
комплексонмен титрлегенде:
MJnd- + Н2У2- «МУ2- + HJnd2- + Н+
қызыл көк
2) ксиленолды қызғылт-сары-алты протонды әлсіз қышқыл H6Jnd,
| CH3 |
| C |
| SO3H |
| CH3 O |
| CH2 |
| N |
| CH2COOH |
| CH2COOH |
| OH |
| CH2 |
| N |
| CH2COOH |
| CH2COOH |
Қышқыл және әлсіз қышқыл ортада Fe3+, Bi3+, Al3+, Zn2+, Cd2+, Cu2+, Zn2+, Hg2+, т.б. иондарымен қызыл түсті комплекстік қосылыс түзеді. Бос күйіндегі түсі рН <6,4 сары, не рН>6,4 қызыл. Ксиленолды қызғылт-сары қатысында рН= 1,5-3,0 аралығында Bi3+, Fe3+иондарын, ал рН 5-7 аралығында Cd2+, Cо2+, Cu2+, Hg2+, Ni2+, Pb2+, Zn2+ иондарын комплексонмен титрлеуге болады.
Индикаторлардың металл иондарымен түзетін комплекстерінің тұрақтылығы ортаның рН-на байланысты, сондықтан анализдегі есептеулерде 8.13-8.15 тендіктеріне a коэффициенттері кіретін шартты тұрактылық константалардың мәнін пайдаланады. Титрлеудің соңғы нүктесі (рМт – т.с.н.) мен эквивалентті нүктесі (рМэкв.н – т.э.н.) сәйкес келмеуі нәтижесінде комплексонометриялық титрлеуде индикаторлық қателер пайда болады. Комплексонометриялық титрлеуде соңғы нүкте эквивалентті нүктеге жетпей анықталады. Мұның себебі - титранттың титрлейтін ионның соңғы мөлшері байланысқан MJnd комплексімен әрекеттесуінде:
∆ рМ = рМт – рМэкв = ℓgbI (MJnd) – 1/2(рМУ + ℓgbI(МУ))
МУ комплкстері белгілі рН-та тұрақты болғандықтан эквивалентті нүктеде М иондары түгел МУ қосылыстарына ауысты деп есептеледі. Осыдан металл иондарының аналитикалық концентрациясы См пайда болған комплекстің концентрациясына тең деп алуға болады См = [МУ].
∆ рМ = ℓgbI (MJnd) – 1/2(р См + ℓgbI(МУ))
Осыдан қатенің мәні аз болу үшін:
1) металл-индикатор комплексінің шартты тұрақтылық константасының мәні bI МJnd >1×104 болуы керек;
2) bМУ және bМJnd тұрақтылық константаларының айырмашылығы бірнеше есе болу керек:
bI МУ / bI МJnd ≥ 102×[ См ]×[ СУ ]
8.4 Әдістің практикада қолданылуы
8.4.1 Судың жалпы кермектілігін анықтау
Судың кермектілігі уақытша (немесе жойылатын) және тұрақты болып екіге бөлінеді. Уақытша кермектілік суда еріп жүрген кальций мен магнийдің бикарбонатты тұздарымен анықталады. Суды қайнатқанда бұл тұздар бұзылып сәйкес карбонаттар түрінде тұнбаға түседі. Тұрақты кермектілік суда еріп жүрген кальций мен магний сульфаттарының нәтижесінде пайда болады. Кальций мен магний иондарының жалпы мөлшері судың жалпы кермектілігі болып есептеледі. Ca2+ мен Mg2+ қоспасын аммиакты буферлі ерітіндіден эрихром қара Т индикаторы қатысында ЭДТА-мен титрлеп анықтайды.
8.4.2 Кальций мен магнийді бірге жүргенде анықтау
Алдымен аммиакты буферлі ерітіндіде эрихром қара Т индикаторы қатысында кальций мен магнийдің жалпы мөлшерін анықтайды. Содан соң үлгінің екінші бөлігінен сілтілік ортада (рН>11) эрихром қара Т индикаторын пайдаланып кальцийдің мөлшерін табады. Бұл жағдайда магнийдің мөлшері екі анықтаудың айырымына сәйкес болады.
8.4.3 Алюминийді анықтау
Алюминийді кері титрлеу жолымен анықтайды. Ол үшін анализдейтін ерітіндіге комплексонның қажеттігінен артық мөлшері қосылып, артық алынған ЭДТА рН 4-5 аралығында мырыштың стандартты ерітіндісімен титрленеді. Индикатор ретінде ксиленолды қызғылт-сарыны алады.
Бақылау сұрақтары мен жаттығулар
1. Комплексонометриялық титрлеуде пайдаланылатын реакцияларға қандай шарттар қойылады?
2. Қандай лигандтар монодентатты және полидентатты деп аталады? Моно-, полидентатты лигандтарды пайдаланып титрлеуге мысал келтіріңдер.
3. Бейорганикалық реагенттердің комплексометиялық титрлеуде шектеулі пайдалануының себебі неде?
4. Қандай органикалық қосылыстар комплексондар деп аталады? Металл иондары мен комплексондар әрекеттескенде қандай комплекстік қосылыстар түзіледі?
5. ЭДТА-ның қасиетің сипаттаңыз.
6. Екі, үш, төрт зарядталған металл иондарымен түзілетін комплексонаттардың құрылымдық формулаларын келтіріңіз.
7. Комплексонометриялық анализдегі көп зарядталған ионардың эквиваленттік факторлары неге тең?
8. Комплексонометриялық титрлеу қисығын құру координаты қандай? Эквивалентті бөлімнің биіктігіне қандай факторлар әсер етеді?
9. Металлхромды индикаторларды пайдалану негізін сипаттаңдар.
10. Са2++У4-«СаУ2- реакциясына сәйкес тепе-тендік константасының теңдігін жазыңдар. Ерітіндінің рН-ы У4- концентрациясына қалай әсер етеді? Осы әсерді ескеріп шартты константаның теңдігін жазыңдар.
11. Ерітіндінің рН 6,0; 8,0; 10,0 тең болғандағы MnУ және SrУ комплексонаттарының шартты тұрақтылық константаларын қорытып шығарыңдар.
12. Al3+, Mg2+ иондарының шартты тұрақтылық константаларының (bI МУ) рН-қа тәуелділігін көрсететін график құрындар (рН өзгеру аралығы 1-2).
13. Cd2+ иондарының ЭДТА-мен түзетін комплексінің шартты тұрақтылық константасын NH3-тің жалпы концентрациясы 0,050М, ал рН 9,0 және 11,0 тең болғанда қорытып шығарыңдар.
14. Шартты тұрақтылық константасын пайдаланып 0,010M BaCl2 ерітіндісін 0,010M ЭДТА ерітіндісімен титрлеудің қолайлы рН-ын анықтаңдар.
15. Шартты тұрақтылық константасын пайдаланып 0,020М ZnCl2 ерітіндісін рН 9,0 болғанда 0,020М ЭДТА ерітіндісімен титрлеуге қолайлы NH3 концентрациясын есептеңдер
16. СdУ комплексінің 0,100М KCN қатысындағы шартты тұрақтылық константасын есептеңдер. Ерітінді рН=1,0.
17. 50,00 мл 0,010М SrCl2 ерітіндісін 0,010М ЭДТА ерітіндісімен титрлеу қисығын қорытып шығарыңдар. Ерітінді рН=11,0.
18. Төмендегі ерітінділердің қоспасындағы рМ мәнін анықтаңдар (рН 9): а) 50,00 мл 0,050 М MgCl2 + 40,00мл 0,050М ЭДТА; б) 25,00 мл 0,050 М ZnSO4 + 25,00 мл 0,050М ЭДТА; в) 20,00 мл 0,100М FeCl3 + 25,00 мл 0,100 М ЭДТА; г) 25,00 мл 0,100 М Pb(NO3)2 + 12,50 мл 0,200 М ЭДТА.
19. 25,00 мл 0,040 М Co(NO3)2 ерітіндісін 0,040 М ЭДТА ерітіндісімен титрлеу қисығын қорытып шығарыңдар. Ерітіндінің рН 9 тең етіп сақтауға аммиакты буфер пайдаланылған, NH3 концентрациясы 0,010М.
20. Mg2+ қатысында Zn2+ иондарын ЭДТА-мен қандай рН-та титрлеу қажет?
21. Сu2+, Pb2+ иондарын KCN қатысында, ал Ni2+, Fe3+ иондарын КҒ қатысында жеке титрлеудің негізі неде?
22. Т(ЭДТА/СаО) = 1,080000 мг/мл тең. Осы ерітіндінің а) эквивалентінің молярлы концентрациясын; б) Т(ЭДТА/MgO); в) Т(ЭДТА/Fe2O3) мәндерін есептеңдер.
23. 3,0 г ЭДТА 1 литрдей суда ерітілген. Оның 50,00 мл титрлеуге 0,004 M Mg2+ ерітіндісінің 32,20 мл жұмсалды. Осы ерітіндінің эквивалентінің молярлы концентрациясын есептеңдер.
24. 50,00 мл құрамында Fe(II) және Fe(III) иондары бар ерітіндіні титрлеуге рН 2,0-де 13,70 мл, рН 6,0-да 29,60 мл 0,012 М ЭДТА жұмсалды. Темірдің әр ионының мөлшері неге тең?
25. 10,00 мл 0,100 М ЭДТА-мен әрекеттесуге құрамында 7,00 % бейтарап қоспасы бар Co(NO3)2 × 6Н2О-нің қанша грамы қажет?
26. 10,00 мл ерітінді дайындауға қажет металл түріндегі мырыштың массасын есептеңіз. Осы ерітіндінің 15,00 мл титрлеуге 20,00 мл 0,200 М ЭДТА жұмсалуы керек.
27. 250,0 мл ерітіндідегі сынаптың массасын анықтау үшін осы ерітіндінің 50,00 мл-не 0,010 М ЭДТА қосылды, артық қалған ЭДТА-ны титрлеуге 10,50 мл 0,010 М MgSO4 жұмсалды. Сынаптың массасын табыңдар.
28. 20,00 мл висмуттың ерітіндісін титрлеуге 17,25 мл 0,070 М ЭДТА жұмсалды. Bi(NO3)3 ерітіндісінің концентрациясын (г/л) табыңдар.
29. Магний хлоридінің стандартты ерітіндісі 250,0 мл өлшем қолбасында 0,1065 г таза магний тотығын тұз қышқылында еріту арқылы дайындалды. Осы ерітіндінің 20,00 мл титрлеуге 19,70 мл ЭДТА жұмсалды. ЭДТА-ның концентрациясын (моль/л) есептеңдер.
30. 2,8850 г қорғасын құймасы 250,0 мл өлшем қолбасында ерітілді. Осы ерітіндінің 25,00 мл титрлеуге 12,30 мл 0,100 М ЭДТА жұмсалды. Құймадағы қорғасының массалық үлесін (%) табыңдар.
31. 0,7634 г Hg(NO3)2× nН2О тұзының 250,0 мл ерітіндісі дайындалды. Осы ерітіндінің 25,00 мл-не 50,00 мл 0,010 М ЭДТА құйылды. Артық қалған ЭДТА-ны титрлеуге 23,83 мл 0,012 М ZnSO4 жұмсалды. Үлгідегі Hg(NO3)2 массалық үлесі қандай?
32. 1,000 г құрамында СаСО3 мен MgСО3 бар үлгіден 100,00 мл ерітінді дайындалды. Осы ерітіндінің 20,00 мл рН 9,0 титрлеуге 19,25 мл, ал екінші 20,00 мл ерітіндіні рН 13 титрлеуге 6,25 мл 0,500 М ЭДТА жұмсалды. Осы қоспадағы СаСО3 мен MgСО3 массалық үлесін (%) есептеңдер.
|
|
Дата добавления: 2014-11-25; Просмотров: 2734; Нарушение авторских прав?; Мы поможем в написании вашей работы!