
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тест тапсырмалары 2 страница
|
|
|
|
[Ag+] = α Ag+∙ CAg+ ; Е=Е0+0,059 lg f Ag+ + 0,059 lg α Ag+ + 0,059 lg C Ag+
Ерітіндінің иондық күші және лигандтың (NH3) концентрациясы тұрақты болғанда реалды (шартты) стандартты потенциал:
Е01=Е0+0,059 lg f Ag+ + 0,059 lg α Ag+ , осыдан Е=Е01+ 0,059 lg CAg+;
потенциалдың мәні жалпы күміс иондарының концентрациясына тәуелді.
Ерітіндінің иондық күші және аммиактың концентрациясы 0,1М сәйкес болғандағы Е 01Ag мәнін табайық:
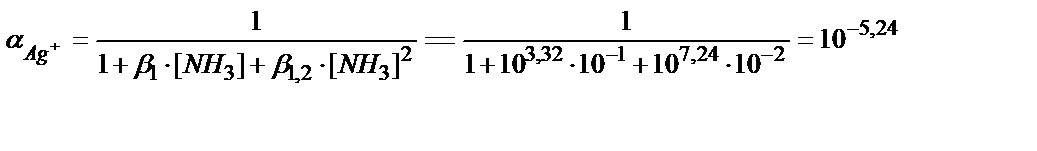 Е01 =0,80 +0,059 lg 0,76+ 0,059 lg 10-5,24 = 0,80-0,007-0,309=0,484 B
Е01 =0,80 +0,059 lg 0,76+ 0,059 lg 10-5,24 = 0,80-0,007-0,309=0,484 B
Комплекс түзілу реакциясы жүргенде потенциалға ерітіндінің иондық күшінің әсері шамалы, сондықтан оны еске алмаса да болады.
Fe3+/Fe2+ жұбының ЭДТА-ның артық мөлшері жүргендегі реалды (шартты) потенциалын анықтайық:
Fe2++Y4- ↔ [FeY]2- β1=2∙1014
 [Fe2+]= C Fe2+∙ α Fe2+;
[Fe2+]= C Fe2+∙ α Fe2+;
Fe3++Y4- ↔ [FeY]- β2=1,3∙1025
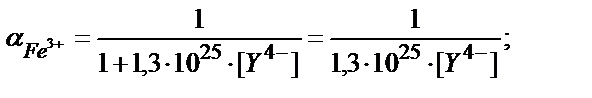 [Fe3+]= C Fe3+∙ α Fe3+;
[Fe3+]= C Fe3+∙ α Fe3+;
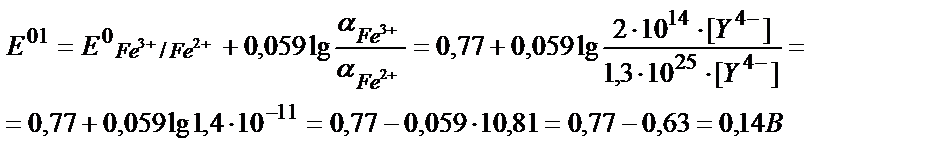
Жалпы түре Mn+ + ne↔M жүйесінің L лигандымен комплекстүзу реакциясын еске алғанда ML, ML2, ML3 ….MLn
СМ=[Mn+]+ [ML]+ [ML2]+……………….... [MLn];
[Mn+] / СМ= αM, осыдан [Mn+] = СМ∙ αM
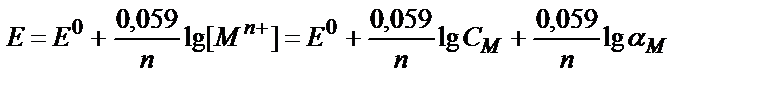
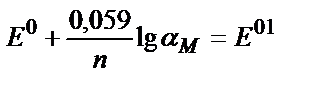
Mn+/ Mm+ (n>m) жүйесіне Mn++ (n-M) ē ↔ MM+
C Mn+ = C ox , C MM+ = C red деп алайық. Сонда:
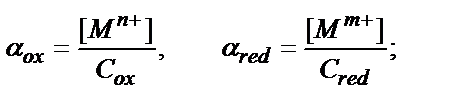
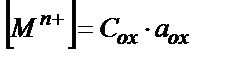 ,
, 
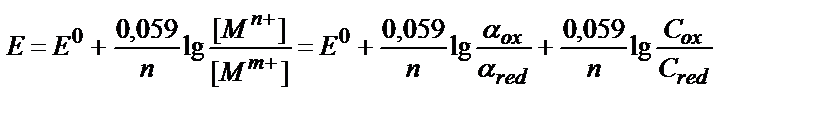 .
.
Тағы бір еске алатын жағдай лигандтың артық мөлшері жүргенде βn мәні β1, β2, β3 …….. βn-1 аралық комплекстердің мәнінен көп болса βn» βn-1……. β3, β2, β1, есептеуге тек βn мәнін алады.
Мысалы, Fe3+/Fe2+ жұбы KCN ерітіндісінде:
Fe3+ + 6CN- ↔ [Fe(CN)6]3- 
Fe2+ + 6CN- ↔ [Fe(CN)6]4- 
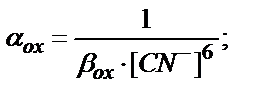

9.3.4. Тұнба түзу реакциясының әсері
Тотығу – тотықсыздану жұбының бір компонентімен бәсекелес тұнба түзу реакциясы сол компоненттің активтігін азайтып, тотығу тотықсыздану потенциалын өзгертеді. Бәсекелес реакцияның әсерін алынған тұнбаның ерігіштік көбейтіндісін пайдаланып ескеруге болады. Мысал ретінде Ag+/Ag жұбы потенциалының осы жүйеге хлорид иондарын қосқандағы өзгеруін қарастырайық:
|
|
|
Е=Е0 + 0,059 lg а Ag+ (9.9)
Хлорид иондарын қосқанда AgCl тұнбасы пайда болады:
ЕКAgCl = аAg+ ∙ аCl- =1,78∙10-10
Ерігіштік көбейтіндісінің мәнінен аAg+ = ЕКAgCl / аCl- (9.10)
(9.10) теңдіктің мәнін (9.9) теңдікке қойсақ:
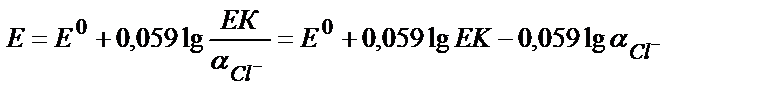
яғни потенциал мәні хлорид иондарының концентрациясына тәуелді теңдік алынады:

0,23 В (AgCl +е → Ag + +Cl-) жартылай реакциясына сәйкес, сондықтан бұл электрод хлор-күмісті электрод деп аталады: Ag, AgCl/Cl- ; а Cl- =1 моль/л болғанда Е0=0,23В. Калий хлоридінің қаныққан ерітіндісінде Е0 Ag, AgCl/Cl- = =0,199 В. Хлор – күмісті электродтың потенциалы хлорид – ионының концентрациясы өзгермесе белгілі температурада тұрақты мән, сондықтан мұндай электрод әртүрлі жүйелердің потенциалын өлшеуде салыстырмалы электрод ретінде пайдаланылады.
9.3. Тотығу – тотықсыздану реакцияларының жылдамдығы
Стандартты тотығу тотықсыздану потенциалдарының мәніне қарай реакцияның жылдамдығын жоруға болмайды. Кейде потенциалдар айырымы үлкен болғанымен реакция баяу жүруі мүмкін. Мысалы, өзара әрекеттесетін жүйелер қымыздық қышқылы мен перманганатттың қышқыл ортадағы стандартты потенциалдардың айырымы 2,0 В, ал темір(ІІІ) мен калий иодидінің потенциалдар айырымы 0,23В. Бірақ екінші реакция:
Fe3+ + 2J- ↔ J2 + Fe2+ үлкен жылдамдықпен жүреді де, бірінші реакция
2MnO4- + 5Н2С2О4 +6H+ ↔ 2Mn 2+ + 8H2O+10 СО2 (9.11)
баяу жүреді.
Мұның себебі тотығу-тотықсыздану реакцияларының күрделілігінде. Тотығу- тотықсыздану реакциялары сатылай аралық қосылыстар түзіп жүреді. (9.11) стехиометриялық реакция жеке сатылардың қосындысынан тұрады. Жалпы реакцияның жылдамдығы реакцияның ең баяу жүретін сатысының жылдамдығымен анықталады. Көптеген тотығу – тотықсыздану реакцияларының жылдамдығы аз, сондықтан бұл реакцияларды жылдамдатудың маңызы зор. Тотығу – тотықсыздану реакцияларының жүруін тездету үшін температураны жоғарлатады, әрекеттесетін заттардың және сутегі иондарының концентрациясын өзгертеді, катализаторлар пайдаланылады. Жоғары температурада реакцияның жылдамдығы артады, температураның 100- қа көбейту реакцияны 2-3 рет жылдамдатады. Сутегі иондары тікелей қатысып жүретін реакциялардың жылдамдығы ерітіндінің рН азайған сайын артады.
|
|
|
Көптеген тотығу – тотықсыздану реакциялары катализатордың қатысында жүреді. Мысалы, 2Mn 2+ + 5S2О8 2- +8H2O ↔ 2MnO4- +10 SО42-+ 8H+ реакциясын жылдамдатуға катализатор ретінде Ag + иондары пайдаланады. Тиосульфат иодарының сутегі пероксидімен тотығуын иодид-иондары (катализатор) жылдамдатады:
Н2О2 + J – → H2O + JO –
JO- + J- + 2H+ →J2 +H2O
J2 + 2S2O32- → 2J- + S4O62-
Жалпы реакцияның теңдігі Н2О2+ 2H+ + 2S2O32- ↔ 2H2O+ S4O62-
Катализатордың әсері көбінесе реакциялық қабілеттігі жоғары аралық қосылыстар түзілуімен анықталады, олар активті радикал, не комплекс болуы мүмкін. Каталитикалық реакцияларға қатарласқан, не индуцирленген реакциялар жақын. Егер өз бетімен жүретін бір реакция (А+В) екінші реакцияның жүруіне себеп (А+А1) болса, мұндай реакцияны қатарласқан не индуцирленген реакция дейді. Екінші реакция бірінші реакциясыз жүрмейді. А – актор, А1 – акцептор, В – индуктор деп аталады. Индуктордың катализатордан айырмашылығы ол міндетті түрде алғашқы реакцияға қатысады және қайтадан пайда болмайды. Қатарласқан реакцияның мысалы ретінде темір(ІІ) ионының сутегі пероксидімен тотығуын қарастыруға болады. Бұл реакцияның нәтижесінде сутегі пероксидінің ажырау реакциясы жүруіне себеп болатын гидроксилдің бос радикалдары пайда болады. Бірінші реакция:
|
|
|
H2O2+Fe2+ → Fe3+ + OH- + ∙OH
∙OH +Fe2+ → Fe3+ + OH-
________________________
H2O2+2Fe2+ →2 Fe3+ + 2OH-
Қатарласқан (индуцирленген) екінші реакция:
H2O2 + ∙OH → H2O+ HO2
H2O2 + HO2 → H2O+ ∙OH + O2
_________________________
2H2O2 → 2H2O + O2
Пайда болған ∙OH реадикалы пероксидтің әрі қарай ажырауына себеп болады. Мұндай индуцирленген реакцияларды тізбектелген реакциялар дейді. Келтірілген реакцияларда пероксидтің бір молекуласы актор, екінші молекуласы акцептор рөлін атқарады, индуктор – темір (ІІ).
Бақылау сұрақтары мен жаттығулар
1. Тотығу – тотықсыздану реакциясы мен алмасу реакциясының қандай айырмашылығы бар? Реакциядағы тотықтырғыш пен тотықсыздандырғыш ролі қандай?
2. Төмендегі реакциялардың жартылай электронды иондық теңдіктерін жазып, коэффициенттерін қойыңдар:
Cr3+ + NaBiO3 + H + → Cr2O72- +Bi3+ + H2O
1. Co 2+ +NO2- + K+ +H+ → K3 [Co(NO2)6]↓+NO+H2O
2. MnO4-+Cr3++H2O→ MnO(OH)2↓ + Cr2O72- +H+
3. NO3-+Al+OH-+H2O→ NH3+Al(OH)4-
4. Sb2S3↓ + NO3-+H+ → HsbO3↓ +SO42- + NO2 +H2O
5. MnO4-+SO32-+ H+→ Mn2+ + SO42- + H2O
6. MnO4-+NO2-+ H+→ Mn2+ + NO3- + H2O
7. Cr2O72-+J- + H+ →Cr3++J2+H2O
8. NO3- + H2S + H+→ NO + S↓ + H2O
9. MnO4-+C2O42-+ H+→ Mn2+ + CO2 + H2O
10. J2+S2O32- → J- + S4O62-
3. Неге сынап H2SO4 –де ерімейді, ал HJ-та сутегін бөліп шығарып ериді?
4. Неге HgS HNO3 –та ерімейді, ал HNO3 пен HCl (1:3) қоспасында ериді?
5. Тотығу – тотықсыздану потенциалы деген не, ол нені сипаттайды?
6. Со2+/Co жұбының стандартты потенциалы -0,40 B. Осы электрод пен қалыпты сутек электродынан тұратын гальваникалық элементте қандай электрохимиялық процестер жүреді? Жалпы реакцияны теңдігін жазыңдар.
7. Mn2+/Mn жұбының Mn2+ концентрациясы 5∙10-3 моль/л болғандағы потенциалын есептеңдер.
8. Төмендегі жүйелердің тотығу – тотықсыздану потенциалына ерітіндінің қышқылдығы қалай әсер етеді: 1) Cr2O72-/2Cr3+, 2) MnO4-/Mn2+; 3)SO42-/ H2S; 4) NO3-/NO; 5) AsO43-/AsO33-?
9. Төмендегі жүйелердің реалды потенциалын есептеңіздер: 1) 0,1 М S4O62-, 0,01 M S2O32-; 2) 1M MnO4-, 0,1M Mn2+, [H+]=0,1 моль/л; 3) 1M Cr3+, [H+] = 0,01 моль/л, 1М Cr2O72-.
|
|
|
10. Cr2O72-/2Cr3+ жүйесінің реалды потенциалының мәнін ерітіндінің рН 1) 0,5; 2) 2,0; 3) 5,0; 4) 10,0 болғанда есептеңдер.
11. Fe 2+ және Fe3+ иондары бар ерітіндіге KCN қосқанда тотығу – тотықсыздану потенциалының мәні неге азаяды?
12. Құрамында KMnO4, MnO2, және 0,01 M KOH бар ерітіндіге салынған Pt электродының потенциалы 0,74B –қа сәйкес. Осы ерітіндідегі KMnO4 тұзының концентрациясы неге тең?
13. 1) 0,3 M HCOOH; 2) 5% NH4Cl ерітінділеріндегі сутегі электродының потенциалын есептеңдер.
14. Сутегі электродының потенциалы -0,53В-қа тең болу үшін 1л 0,1М NH3 ерітіндісінде неше грамм NH4Cl еріту керек?
15. 1л 0,1М CH3COONa және 100 мл 0,1 M CH3COOH араластырып алынған ерітіндідегі сутегі электродының потенциалын есептеңдер.
16. Келтірілген металдардың қайсысы H+ иондарын H2-ге дейін тотықсыздандыра алады: Cd, Sn, Sb, Al, Ag?
17. AgJ – тің ерігіштік көбейтіндісі 1∙10-16 , 1M HJ ерітіндісіндегі күміс электродының потенциалын есептеңіздер. Осы ерітіндіден күміс сутегін ығыстырып шығара ала ма?
18. (-) Pt / H2 (газ) H2SO4 (1M) // AgNO3 (0,1M)/ Ag(+) келтірілген гальваникалық элементтің Ag+/Ag жартылай элементіне CN- ионының концентрациясы 1 моль/л болғанша KCN тұзы салынады. [Ag(CN)2]-комплексінің тұрақтылық константасы 1∙10+20. Осы жағдайда тізбектегі токтың бағыты өзгере ме?
19. Төмендегі тотығу тотықсыздану реакцияларының тепетеңдік константаларын есептеңдер:
1) Sn 2+ + J2 ↔ Sn4+ + 2J-
2) 2MnO4- + 5NO2- + 6H+ ↔ 2Mn2+ + 5NO3- + 3H2O
3) 2Fe3+ + SnCl42- + 2Cl- ↔ 2Fe 2+ + SnCl62-
4) Cr2O72- + 6Fe2+ +14H+↔2Cr3+ + 6Fe3+ + 7H2O
5) MnO4- + 5Fe2+ + 8H+ ↔ Mn2+ + 5Fe3+ + 4H2O
6) Cr2O72- + 6J- +14H+↔2Cr3+ + 3J2 + 7H2O
7) 2S2O32- + J2 ↔ S4O62- + 2J-
1. Мына берілген теңдеулердің қайсысы тотығу-тотықсыздану реакциясының тепе-теңдік константасы мен потенциалы арасындағы тәуелділікті дұрыс сипаттайды?
1) T lgK = 4970 n?E; 2) 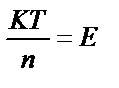 ; 3)
; 3) 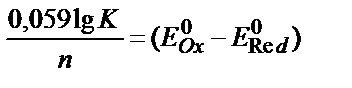 ;
;
4) T lgK = n?E; 5) дұрыс жауап берілмеген.
2. Мына Fe3+/Fe2+-редокс жұптың (E0Fe(Ш)/Fe(11)=+0,77 B) тотыққан және тотықсызданған түрлері концентрацияларының қатынасы қандай болғанда жүйенің реалды потенциалы оның стандартты потенциалы шамасынан төмен болады (E01 < E0)?
1) [Fe3+] / [Fe2+] = 1: 1;
2) [Fe3+] / [Fe2+] = 1: 10;
3) [Fe3+] / [Fe2+] = 10: 1;
4) [Fe3+] / [Fe2+] = 5: 2;
5) [Fe3+] / [Fe2+] = 5: 5.
3. Берілген MnO4-/ Mn2+жүйесінің реалды потенциалын қышқылдық ортада мына теңдеумен анықтауға болады:
1) 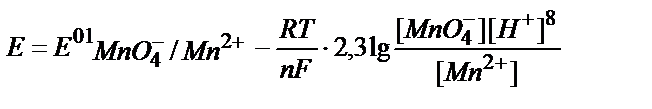 ;
;
2) 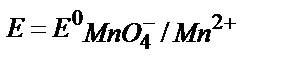 ;
;
3) 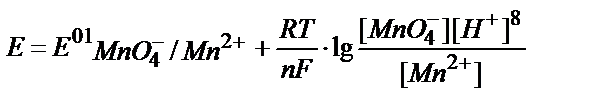 ;
;
4)  ;
;
5) 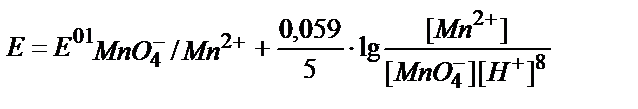 .
.
4. Берілген тотыққан-тотықсызданған жүйелердің қайсысының потенциалдары шамасына ерітінді рН-ның өзгеруі әсер етпейді?
1) Cr2O72-/ 2Cr3+; 2) MnO4-/ Mn2+; 3) SO42-/ H2S;
4) Fe3+/ Fe2+; 5) NO3-/ NO.
5. Hg22++2e ↔2Hgoтепе-теңдігі орнаған жүйеде мына реакция бойынша Hg22++ 2Cl-↔ Hg2Cl2↓ суда нашар еритін қосылыс түзілген жағдайда (T=293 K) жүйенің тотығу-тотықсыздану потенциалы қайсы теңдеу бойынша анықталады?
1) E = E0 + (0,059/2) lg ЕК – 0,059 lg [Cl-];
2) E = E0 + 0,029 lg ЕК – 0,058 lg [Cl-];
3) E = E0 – 0,058 lg ЕК – 0,058 lg [Cl-];
4) E = E0 + 0,059 lgЕК + 0,058 lg [Cl-];
5) E = E0 – 0,029 lg ЕК – 0,058 lg [Cl-].
6. Ag++ e → Agoжүйеде қатты фаза (тұнба) түзілген жағдайда реалды стандартты потенциал шамасы мына теңдеумен анықталады (T = 298K):
1) E01 = E0 + 0,059 lgЕК; 2) E01 = E0 – 0,058 lgЕК;
3) E01 = E0 + 0,059 pЕК; 4) E01 = E0 – (RT/nF) 3,3 lgЕК;
5) E01 = E0 + (RT/F) 2,3 lnЕК.
7. Тотықтырғыштар ретінде қолданылатын қосылыстар қатарын анықтаңыз:
1) Na2S2O8, HNO3, Na2S2O3; 2) KJO3, PbO2, HJ;
3) K2Cr2O7, H2O2, SnCl2; 4) KMnO4, Na2CrO4, HNO3;
5) KClO3, H2S, H2SO4.
8. ClO3-ионы Cl--ионына дейін тотықсызданғанда, ClO3-/Cl-жүбының тотығу-тотықсыздану потенциалын қандай формуламен есептеуге болады?
1)  ; 2)
; 2) 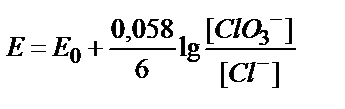 ;
;
3) 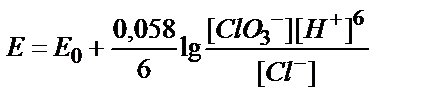 ; 4)
; 4) 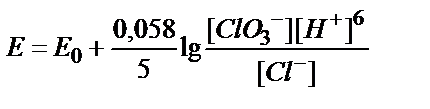 ;
;
5) 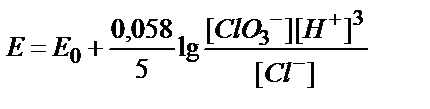 .
.
9. Қандай жағдайда MnO4-+8H++5e↔Mn2++4H2O жартылай реакциясының потенциалы оның стандартты потенциалына тең болады?
1) aох = aRed = 1, pH = 1;
2) aох = aRed = 1, pH = 7;
3) aох = aRed (кез келген a үшін);
4) aох = aRed = 1, a(H+)= 1;
5) aох = aRed, pH = 1.
10. T=298K-да (Ox+ne ↔ Red) жүйесінің тотығу-тотықсыздану потенциалы шамасына ерітіндінің иондық күшінің әсерін дұрыс ескеретін теңдеуді көрсетіңіз:
1) 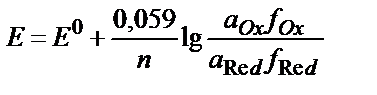 ;
;
2) 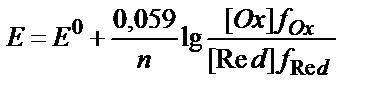 ;
;
3) 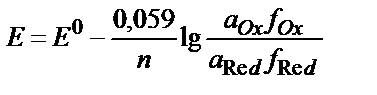 ;
;
4) 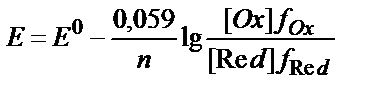 ;
;
5)  .
.
11. Мына тотықсыздандырғыштың қайсысының тотыққан түрі ең күшті тотықтырғыш болады?
1) H2SO3 E0 (SO42-/SO32-) = +0,17B;
2) Sn2+ E0 (Sn4+/Sn2+) = +0,15B;
3) H2O2 E0 (O2/H2O2) = +0,69B;
4) Cr3+ E0 (Cr3+/Cr2+) = -0,41B;
5) Na2S2O3 E0 (S4O62-/2S2O32-) = +0,09B.
12. Темір қосылысы тотықсыздандырғыш ретінде қатысатын процестің теңдеуін көрсетіңіз:
1) Sn2+ + 2 Fe3+ ↔ Sn4+ + 2Fe2+; 2) Fe2+ + S2+ ↔ FeS↓;
3) FeO + Mg ↔ Fe + MgO; 4) 2Fe2+ + H2O2+ 4OH-↔ 2Fe (OH)3↓;
5) Fe2O3 + 3H2 ↔ 2Fe + 3H2O.
13. Сутек асқын тотығы тотықтырғыш ретінде қатысатын процестің теңдеуін көрсетіңіз:
1) 2CrO2-+ 3H2O2+ 2OH-↔ 2CrO42-+ 4H2O;
2) 2MnO4-+ 5H2O2+ 6H+↔ 2Mn2++ 5O2+ 8H2O;
3) O3+ H2O2↔ H2O + 2O2;
4) MnO(OH)2+ H2O2+ 2H+↔ Mn2++ O2+ 2H2O;
5) Ag2O + H2O2↔ 2Ag + H2O + O2.
14. Келтірілген реакциялардың қайсысы диспропорциялану реакциясына жатпайды?
1) H2O2+ H2O2↔ 2H2O + O2;
2) 4ClO3-↔ 3ClO4-+ Cl-;
3) 3Au+↔ Au3++ 2Auо;
4) 3Mn2++ 2MnO4-+ 7H2O ↔ 5MnO(OH)2↓ + 4H+;
5) дұрыс жауап берілмеген.
15. Қайсы теңдеу Zn2+/Zn↓ жұбының тепе-теңдік потенциалы мен заттың тотыққан және тотықсызданған түрлері концентрациялары арасындағы байланысты дұрыс көрсетеді?
1) 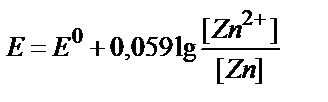 ;
;
2)  ;
;
3)  ;
;
4) 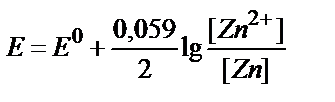 ;
;
5) E = E0 + 0,059 lg[Zn2+].
16. Тотығу-тотықсыздану реакциясының электрқозғаушы күшін (ЭҚК) қалай есептеуге болады?
1) ЭҚК = Eооx– Eоred; 2) ЭҚК = Eored– Eoox;
3) ЭҚК = Eoox+ Eored; 4)  ; 5)
; 5) 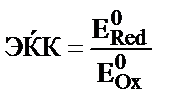 .
.
17. Ерітіндіде бірмезгілде бірге жүрген иондар қандай ретпен тотығады?
(EoSo/S2-= +0,14 B; EoSO42-/SO32-= +0,17 B; E0І2/2І-= +0,536 B; EoBr2/2Br-= +1,087 B)
1) Br-, І-, SO32-, S2-; 2) S2-, І-, Br-, SO32-; 3) І-, Br-, SO32-, S2-;
4) S2-, SO32-, І-, Br-; 5) SO32-, І-, S2-, Br-.
18. AgClқат.+e ↔Agқат.+Cl-жартылай реакциясы үшін оның реалды стандартты потенциалының теңдеуін көрсетіңіз.
1) 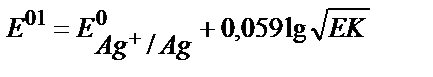 ;
;
2) 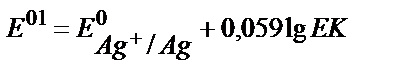 ;
;
3) 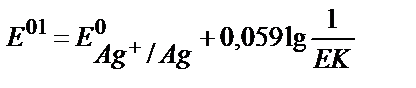 ;
;
4) 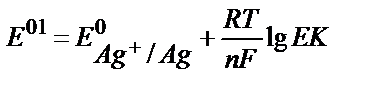 ;
;
5) 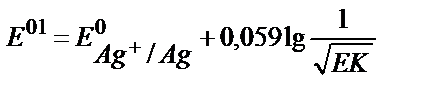 .
.
19. Sn2++2Fe3+ 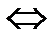 Sn4++2Fe2+реакциясы үшін тепе-теңдік орнауын сипаттайтын жағдайлар:
Sn4++2Fe2+реакциясы үшін тепе-теңдік орнауын сипаттайтын жағдайлар:
1) [Fe3+] = [Fe2+], [Sn2+] = [Sn4+]; 2) EоFe3+/Fe2+= EоSn4+/Sn2+;
3) EFe3+/Fe2+= ESn4+/Sn2+; 4) [Sn2+] > [Fe2+], [Sn4+] < [Fe3+];
5) [Sn2+] = [Fe2+]2, [Sn4+] = [Fe3+]2.
20. Қандай жүйенің тотығу-тотықсыздану потенциалы мәніне ерітінді рН әсер етпейді?
1) MnO4-/Mn2+; 2) AsO43-/AsO33-; 3) 2ІO3-/І2;
4) І2/2І-; 5) Cr2O72-/2Cr3+.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1457; Нарушение авторских прав?; Мы поможем в написании вашей работы!