
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сер ететін факторлар 2 страница
|
|
|
|
3HgS↓ + 2HNO3 + 12HCl → 3H2[HgCl4] + 3S↓ + 2NO + 4H2O
Патша сұйығы тотықтырғыш қасиетінен басқа сынап(ІІ) иондарын комплекстік иондарға [HgCl4]2- ауыстырады. Тұнбаның құрамындағы екі ион да басқа тұрақты қосылысқа айналғандықтан тепе-теңдік тұнбаның еру жағына қарай ығысады.
4) Тұнба иондарын комплекстік қосылысқа айналдыру. Тұнбаның құрамына кіретін бір ионмен тұрақты комплекс түзетін зат сол ионның ерітіндідегі концентрациясын азайтып, тұнбаның ерігіштігін арттырады. (αM < 1, αA = 1):
MA ↓↔ M + A 
+L
↕ 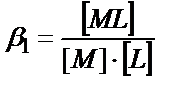 (11.13)
(11.13)
ML
+L ↕ 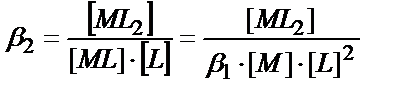 (11.13)
(11.13)
ML2
……………………………………………………………………
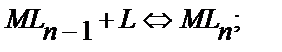
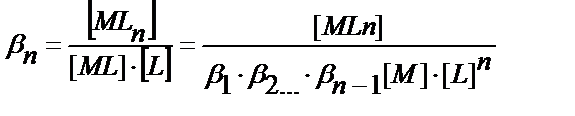 (11.14)
(11.14)
M мен A бір, екі, үш т.б. зарядталған иондар болуы мүмкін, ал L молекула не ион түрінде жүрген комплекстүзгіш.
Бәсекелес комплекс түзу реакциясының коэффициеті αM = [M] / CM табу қажет. Металл иондарының жалпы концентрациясы
CM = [M] + [ML] + [ML2] ……..[MLn] (11.15)
(11.12-11.14) теңдіктерінен комплекстік бөлшектерінің концентрацияларының мәндерін тауып (11.15) теңдікке қойсақ:
CM = [M] ∙(1+β1∙[L] + β1 ∙β2 ∙[L]2 …..+ β1 ∙β2….∙βn ∙[L]n;
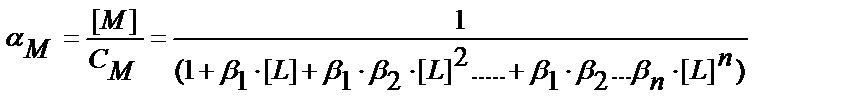
ЕК= [M] ∙[A] = αM∙CM∙[A]; ε = CM∙[A]; ЕК= αM ∙ ε2 ; ε2 = ЕК / αM;
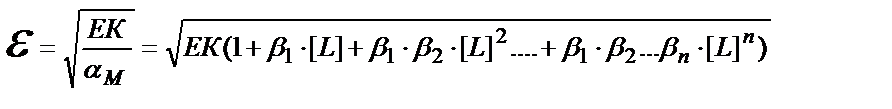
Мысалы, күміс иодидінің 0,1 M аммиак ерітіндісіндегі ерігіштігін есептейік. EK AgJ = 9 ∙10-17, күмістің аммиакты комплекстерінің сатылай түзілу константалары: β1= 1,6 ∙ 10 3; β2 =6,3∙103.


Іс жүзінде бұл тұнбаның аммиактың судағы ерітіндісінде ерімейді деуге болады, ал EK = 1,8 ∙10-10 тең AgCl тұнбасы үшін:
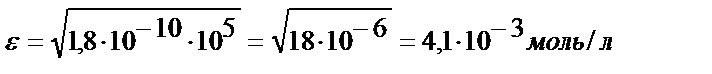 яғни ол аммиактың артық мөлшерінде ериді.
яғни ол аммиактың артық мөлшерінде ериді.
|
|
|
Егер тұнбаның ерігіштігі ерітіндіде жүрген металл иондарын байланыстыратын лигандтар мен аниондарды байланыстыратын сутегі иондарына тәуелді болса және ерітіндінің иондық күшін ескеретін болсақ, тұнбаның ерігіштігін есептейтін теңдік былай жазылады:
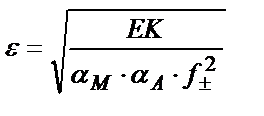
5) Күшті күкірт қышқылының нашар еритін тұздары CaSO4, SrSO4, BaSO4 қышқылдарда ерімейді. Сондықтан бұл тұнбаларды еріту үшін алдымен оларды қышқылдарда жақсы еритін карбонаттарға айналдырады.
EK (CaSO4)=2,5 10-5; EK (SrSO4) = 3,2 10-7; EK (BaSO4) = 1,1 10-10
EK (CaSO3)= 4,8 10 -9; EK (SrSO3)= 1,1 10-9; EK (BaSO3) = 5,1 10-9
Бір нашар еритін қосылысты екінші нашар еритін қосылысқа айналдыруға болатын-болмайтынын реакцияның тепе теңдік константасын есептеп анықтауға болады:
MSO4↓+CO32- ↔ MCO3↓ + SO42-

Мысалы, келтірілген сульфаттардың карбонаттарға ауысу мүмкіндігін қарастырсақ:


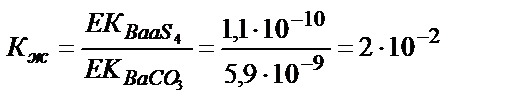
Кальций мен стронций сульфаттары карбонаттарға жеңіл ауысады, себебі алынған тұнбаның ЕК әрекеттестіретін тұнбаның ЕК-нен әлдеқайда аз, соған сәйкес тепе-теңдік константасының мәні үлкен. Барийға сәйкес тепе-теңдік константасының мәні 1>2∙10-2>10-4 болғандықтан бұл реакция жүру үшін реактивтің артық мөлшері қажет. BaCO3 тұнбасы түзілу үшін [Ba2+]∙[CO32-] > EK (BaCO3) болу керек, не [Ba2+] > EK (BaCO3) /[CO32-]. Бұл жағдайда барий иондарының концентрациясы BaSO4 тұнбасының ерігіштігімен анықталады: [Ba2+] = EK (BaSO4) /[SO42-]. Барий сульфаты барий карбонатына ауысу үшін мынадай жағдай болу керек:
EK (BaSO4) / [SO42-] > EK (BaCO3) / [CO32-]
Осыдан [CO32-]/[SO42-]>EK(BaCO3)/EK(BaSO4) 
[CO32-] / [SO42-] > 50, яғни карбонат иондарының 50 еседен артық мөлшері қажет. Барий сульфатының карбонатқа ауысу реакциясының нәтижесінде:
|
|
|
ВаSO4↓+CO32- ↔ ВаCO3↓ + SO42-
Карбонат иондарының концентрациясы азаяды да, сульфат иондарының концентрациясы артады, екі ионның қатынасы 50-ге теңескенде тепе теңдік орнайды да, сульфаттың карбонатқа айналу реакциясы тоқтатылады. Ал егер тұнбаның үстіндегі ерітіндіні төгіп тастап, оны Nа2CO3 ерітіндісінің жаңа үлесімен әрекеттестірсе, онда карбонат түзілу реакциясы жаңадан басталады. Осы операцияны бірнеше рет қайталаса, ВаSO4 тұнбасын толық ВаCO3 -ке айналдыруға болады.
11.4. Тұнбаға түсіру процесін заттарды бөлуде қолдану
11.4.1. Фракциялық тұндыру
Егер ерітіндідегі екі әр түрлі иондар бір реактивпен нашар еритін қосылыстар берсе, осы иондардың қоспасына реактивті құйғанда алдымен ерігіштігі нашар қосылыс тұнбаға түседі. Тәжірибеде екінші ион тұна бастағанша қаншалықты бірінші ион тұнбаға толық түскенін анықтаудың маңызы зор. Мысалы, ерітіндіде иодид- және хлорид- иондарының қоспасы бар дейік. Егер осы ерітіндіге ептеп күміс нитратын қоссақ алдымен ерігіштік көбейтіндісінің мәні аз (8,3 ∙10-17) AgJ тұнбасы түсе бастайды, содан кейін тұнбаның үстіндегі ерітіндіде хлорид- және күміс- иондарының концентрацияларының көбейтіндісі күміс хлоридінің ерігіштік көбейтіндісінен артқанда (ИК >EK (AgCl) (1,78 ∙ 10-10)) AgCl тұнбаға түсе бастайды. Ерітінді екі тұнбамен де тепе теңдік жағдайда болады, яғни ерітіндідегі иондардың концентрациясы мына теңдіктермен анықталады:
[Ag+] ∙ [J-] =EK (AgJ) = 8,3 ∙10-17 (11.16)
[Ag+] ∙ [Cl-] =EK (AgCl) = 1,78 ∙10-10 (11.17)
(11.16) және (11.17) теңдіктерден:
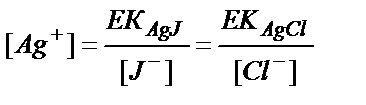 (11.18)
(11.18)
Тұнбада AgCl және AgJ бірге жүргенде:
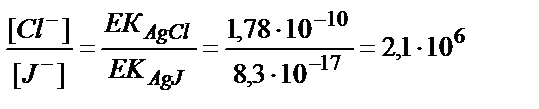 не
не
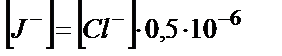 (11.19)
(11.19)
Егер хлорид- және иодид- иондарының алғашқы концентрациясы 0,1 М болса, онда күміс хлориді ерітіндідегі иодид- иондарының концентрациясы  моль/л- ге дейін азайғанша тұнбаға түспейді, яғни екі ион бір бірінен толық бөлінеді. Тек AgJ толық тұнбаға түскенін анықтап білу керек. Ол үшін иод- крахмал индикаторын пайдаланады. Алғашқыда ерітінді көк түске боялады, себебі иодид иондарының қатысында крахмалды көгертетін J3- иондары (J2+J-→J3-) пайда болады. Иодид- иондары толық тұнбаға түскеннен кейін ерітінді түссізденеді. Бос иод- крахмал қоспасы түссіз.
моль/л- ге дейін азайғанша тұнбаға түспейді, яғни екі ион бір бірінен толық бөлінеді. Тек AgJ толық тұнбаға түскенін анықтап білу керек. Ол үшін иод- крахмал индикаторын пайдаланады. Алғашқыда ерітінді көк түске боялады, себебі иодид иондарының қатысында крахмалды көгертетін J3- иондары (J2+J-→J3-) пайда болады. Иодид- иондары толық тұнбаға түскеннен кейін ерітінді түссізденеді. Бос иод- крахмал қоспасы түссіз.
|
|
|
Фракциялық тұндыру заттарды бір-бірінен бөлуге жиі пайдаланылады.
11.4.2. Тұнбаға түсіргіштің концентрациясын қадағалай отырып бөлу
Көптеген табиғи үлгілерді зерттегенде заттардың қоспасын бөлу үшін тұнба алу реакциясы кең пайдаланылады. Ол үшін әртүрлі әдістерді қолдануға болады:
Иондарды тұнбаға түсіргіштің концентрациясын қадағалап бөлу. Бұған дейін айтылғанындай, егер екі ион үшінші ионмен ерігіштігі әртүрлі тұнба берсе, онда алдымен ерігіштігі азы тұнбаға түседі. Екі тұнбаның ерігіштігінде айырмашылық үлкен болса ерітіндіден бір ионды екінші ион тұбаға түскенге дейін толық бөліп алуға болады. Ол үшін тұнбаға түсіргіштің концентрациясын алдын ала анықталған деңгейде тұрақты етіп ұстау керек.
Фракциялық тұндыруға көптеген маңызды аналитикалық бөлулер негізделген. Соның ішінде сульфид-, гидроксид-иондарын, органикалық реактивтерді т.б. пайдаланып бөлу.
Ерігіштік көбейтіндісі заңдылығын пайдаланып теориялық тұрғыда фракциялық тұндыру жолымен заттардың қаншалықты толық бөлінетінін бағалауға болады.
11.4.2.1. Гидроксидтер түрінде бөлу. Егер аз еритін металл гидроксидтері М(ОН)2, М(ОН)3 ерітіндімен тепе-теңдікте болса, онда:
[M2+]∙[OH-]2=EK (M(OH)2); [M3+]∙[OH-]3=EK (M(OH)3).
Осыдан
 не
не
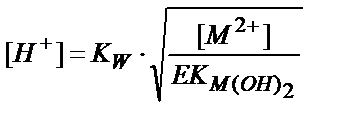 , (11.20)
, (11.20)
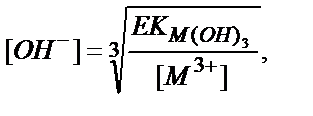
 (11.21)
(11.21)
Егер гидроксидтердің ЕК белгілі болса (11.20), (11.21) теңдіктерді пайдаланып белгілі рН-та металл иондарының қандай үлесі ерітіндіде қалатынын және қандай рН-та гидроксидтердтің толық тұнбаға түсетінін есептеуге болады.
|
|
|
Мысалы, Fe3+ және Mg 2+ катиондарын (0,1 М) ерітіндіден гидроксид иондарын пайдаланып фракциялық тұндыру жолымен бөлуге бола ма?
EK (Fe(OH)3) = [Fe3+]∙[OH-]3 = 4∙10-38
EK (Mg(OH)2) = [Mg2+]∙[OH-]2= 1,8 ∙10-11
ЕК аз болғандықтан алдымен Fe(OH)3 тұнбаға түседі, сондықтан Fe(OH)3 қандай рН -та толық түсетінін есептейміз. Егер ерітіндіде тұнбаға түсетін ионның концентрациясы 10-6 моль/л – ге дейін кемісе, ол толық тұнды деп есептеледі:
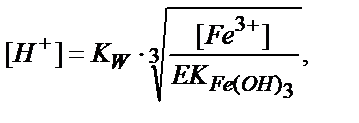

Ерітіндінің рН 3 деңгейінде ұстаса темір иондары толық тұнбаға түседі.
Енді осы рН – та магний гидроксиді тұнбаға түсе ме деген сұраққа жауап берейік: [OH-]= 10-11М:
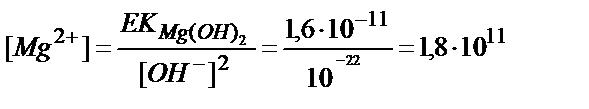 М.>>10-1М.
М.>>10-1М.
Жоқ, түспейді, олай болса қандай pH-та Mg(OH)2 тұнбаға түсе бастайды?
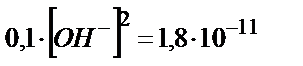 ;
;  ,
,  .
.
Ерітіндінің pH>9 болғанда Mg(OH)2 тұнбаға түседі, ал pH<9 болғанда тұнбаға түспейді. Сондықтан Fe3+, Mg 2+ иондарын толық бөлу үшін ерітіндінің pH 3 пен 9 арасында ұстау керек.
11.1 – кестеде әртүрлі гидроксидтердің тұнбаға түсуіне сәйкес pH мәндері келтірілген.
11.1 – кесте
Әртүрлі гидроксидтерді тұндыруға сәйкес рН мәндері
| рН | II | ||||||
| Гидроксидтер | Mg(II) | Mn(II) Hg(II) | Co(II), Ni(II), Cd(II) | Fe (II) Pb(II) | Cu (II), Cr(III), Zn(II) | Al(III) | Fe(III) |
11.4.2.2. Сульфидтер түрінде бөлу. Көптеген металл иондарын бөлу әдістерінде тұнбаға түсіргіш анионның концентрациясын, ерітіндінің pH-ын реттеу арқылы, белгілі деңгейде ұстап тұруға болады. Бұл әдістердің ең белгілісі – күкіртті сутегін пайдаланып тұнба түсіру.
 (11.22)
(11.22)
(11.22) тендіктен S2- концентрациясы сутегі ионының концентрациясына тәуелді болғандықтан сульфидтердің тұнбаға түсуі не туспеуі ерітіндінің pH-на байланысты. Қышқылдық ортада тек ерігіштік көбейтіндісі аз катиондардың сульфидтері тұнбаға түсуі мүмкін. Керісінше бейтарап не сілтілік ортада ерігіштігі өте аз сульфидтермен қатар ЕК әлдеқайда үлкен сульфиттер де тұнады. Осыдан, S2- иондарымен тұндыpғанда ерітіндінің pH реттеп катиондарды бөлуге болады. Мысалы, Cd2+ және Zn2+ катиондарының бір-бірінен толық бөлінетін жағдайын қарастырайық. ЕКCdS = 7,9·10-27; ЕКZnS=2,5 ∙10-22.
Ол үшін CdS толық тұнбаға түскенде ерітіндіде қалған кадмий иондарының концентрациясы 10-6 моль/л десек:
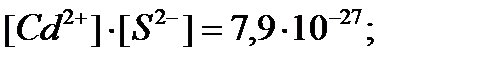


 ;
;  ,
,
CdS ерітіндінің pH 0,41 болғанда тұнбаға толық түседі. Күкіртті сутегімен әрекеттескенде реакция нәтижесінде:
Cd2++H2S→ CdS↓ +2H+
сутегі иондары бөлінетіндіктен ерітіндінің pH ептеп кемиді, сондықтан тұндыруды pH есептелінген мәннен сәл көп болғанда бастайды, яғни pH 0,5, бұл [H3O+]=0,3 моль/л сәйкес. Бұл жағдайда ZnS тұнбаға түсе ме?
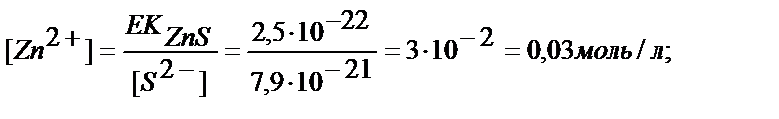
Мырыш сульфиді [Zn2+] >0,03 моль/л болса ғана түседі. Сонымен келтірілген екі катионды бөлу үшін ерітіндінің pH-ын 0,4  0,5 деңгейінде ұстау керек.
0,5 деңгейінде ұстау керек.
Еске алатын бір жағдай – фракциялық тұндыруда заттардың толық таза бөлінуіне ерігіштігі жоғарырақ қосылыстың ерігіштігі төмен қосылыспен қосарлана тұну құбылысы әсер етеді.
Бөлінетін заттарды түгел тұнбаға түсіріп, содан кейін біреуін ерітіп, екіншісін тұнбада қалдыру тәсілі.
1) Мысалы, Cd2+ және Sn2+ иондары бар ерітінді арқылы pH 0,5-ке келтіріп күкіртті сутегін қаныққанша жіберсе, CdS, SnS тұнбалары толық түседі. Егер осы тұнбаларды полисульфидті аммониймен әрекеттестірсе SnS ериді де, ал CdS тұнбада қалады. Полисульфидті аммонийді аммоний сульфидін бос күкіртпен қанықтырып алады: (NH4)2Sn, n-2 мен 5 аралығында өзгереді. Көпкүкіртті аммоний пероксидке ұқсас, сондықтан тотықтырғыш қасиет көрсетеді. Ең қарапайым көпкүкіртті аммоний-(NH4)2S2: – аммонийдің дисульфиді:
(NH4)2S2↔2NH4++S2-+S, не
(NH4)2S2↔2NH4++S22- ыдырайды S22-→ S2- + S0
S22-+2е → 2S2- не S+2е → S2-
SnS + (NH4)2S2 → (NH4)2SnS3, яғни қалайы сульфиді амфотерлік қасиет көрсетіп, қалайының тиотұзын түзеді.
2) Fe3+ пен Mg2+ иондары бар ерітіндіге NH3∙H2O+(NH4)2HPO4 қоспасын қосса FePO4 және MgNH4PO4 тұнбалары түседі. Осы тұнбаны сірке қышқылымен (pH 3) әрекеттестіріп FePO4- ті тұнбада қалдырып, магний фосфатын ерітуге болады.
ЕК (MgNH4PO4) = 2,5∙10-13, 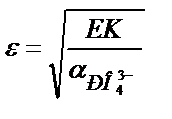
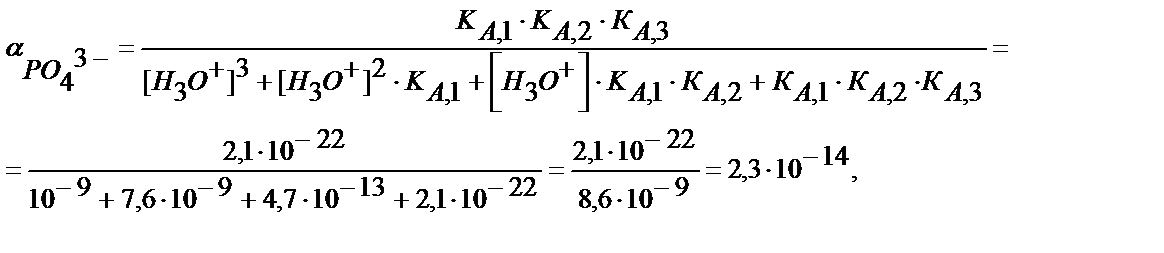
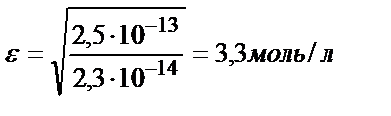 MgNH4PO4 толық ериді.
MgNH4PO4 толық ериді.
Ал FePO4,  ерімейді.
ерімейді.
11.4.3. Тұнбалардың ерігіштігін пайдаланып, тұнбаларды бір-бірінен комплекстүзгіш қатысында бөлу
Егер катиондардың қоспасын аммоний тұзының қатысында аммиактың судағы ерітіндісімен әрекеттестірсе (рН 9) Mg2+ , Mn2+ катиондары тұнбаға түспейді, себебі бұл жағдайда олардың ИК<ЕК(M(OH)2). Мыс, мырыш, никель, кадмий, кобальт гидроксидтері аммиактын артық мөлшерінде комплекстік қосылысқа айналып еріп кетеді. Мысалы:
Cu(OH)2+4NH3 →[Cu(NH3)4]2++2OH-
Ал алюминий, висмут, хром (ІІІ), темір (ІІІ) иондары рН 9-да толық тұнбаға түседі. Бұл бөлуде аммоний тұздарын көп мөлшерде құйған жөн, себебі: 1) аммоний тұздары ерітіндінің рН белгілі мөлшерде тұрақты етіп ұстайды, сондықтан Al(OH)3-тің ерігіштігі азаяды; 2) аммоний тұздарының артық мөлшері кальций, магний, мырыш, никель т.б. катиондардың қосарласа түсуіне кедергі жасайды.
Комплекстүзудің тағы бір пайдаланатын жері – кальцийді магний иондары қатысында рН 4 сәйкес ерітіндіден оксалат түрінде тұнбаға түсіру СаС2О4↓. Магний оксалаты (NH4)2C2O4-тің артық мөлшерінде комплекстік қосылыс түзу нәтижесінде ериді. Төмендегі мәндерден MgC2O4-тің таза судағы ерігіштігі аз, (NH4)2C2O4-тің концентрациясы артқан сайын магний оксалатының ерігіштігі артатынын көруге болады:
| (NH4)2C2O4∙Н2О, концентрациясы, моль/л | 0,15 | 0,30 | |
| MgC2O4∙2Н2О, 22оС ерігіштігі, моль/л | 2,4∙10-3 | 6,4∙10-3 | 1,2∙10-2 |
Сонымен қатар қымыздық қышқылы әлсіз қышқыл болғандықтан, оксалаттардың толық тұнбаға түсуі ерітіндінің рН-на да байланысты:
MC2O4↔M2+ + C2O42-
C2O42-+ H+ ↔ HC2O4- Kа,2 = 5,4 10-5
HC2O4-+ H+ ↔ H2C2O4 Kа,1 = 5,6 10-2
Ерітіндінің рН=4 болғанда кальций мен магний оксалаттардың қаншалықты толық тұнбаға түсетінін қарастырайық:

рН 4 болғанда CaC2O4 ерігіштігі:
EK(CaC2O4)=2,3∙10-9,
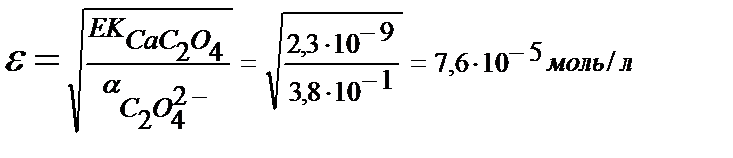
Тұнба түсіруге аммоний оксалатының артық мөлшерін алғандықтан тұнбаның ерігіштігі келтірілген мәннен де төмен болады.
рН 4-те MgC2O4-тің ерігіштігі:
EK(MgC2O4)=8,6∙10-5, 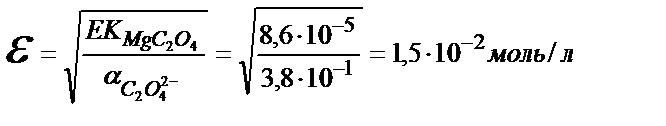
және магний оксалатының ерігіштігі оксалатты комплекс түзілу нәтижесінде артады.
11.5. Тұнбалардың пайда болуы және олардың қасиеттері
Тұнбалардың пайда болуы әлі аяғына дейін шешілмеген, күрделі физика- химиялық процесс. Тұнбаның қасиеті көбінесе тұнбаның пайда болу механизмінің ішіндегі екі сатымен анықталады. Ол: 1) кристалдану орталығының (кристалдардың ұрығы) пайда болуы; 2) пайда болған ұрықтардың әрмен қарай өсуі. Жаңа пайда болған бөлшектердің мөлшері осы екі сатының қайсысы басым болуына байланысты. Кристалдану орталығының пайда болуы ең аз мөлшердегі иондар не молекулалардың бірігіп тұрақты екінші фаза түзу процесі. Мысалы, күміс хроматының ұрығы 6, барий сульфатының ұрығы 8 иондардан тұрады. Тұнбаның әрмен қарай тұнуы не жаңа орталықтардың пайда болуы, не алғашқы ұрықтардың әрмен қарай өсуі жолымен жүреді. Егер тұну бірінші жолмен жүрсе тұнба көп мөлшерде өте ұсақ бөлшектерден тұрады, егер екінші жол басым болса, онда ірі кристалды тұнба алынады.
Сапалық түрде қандай тұнба түсетіні ерітіндінің қаншалықты аса қаныққандығына байланысты. Оны салыстырмалы асақанығу (САҚ) дейтін мәнмен сипаттауға болады:
САҚ= 
Q – тұндырар алдындағы араластырылатын реагенттердің молярлі концентрациясы, Q = C/2;
ε – тепе – теңдік орнағаннан кейінгі тұнбаның молярлі ерігіштігі.
Нашар еритін тұнба түсу процесінде тұнба түсіргіштің қосылған әр үлесі ерітіндінің аса қанығуына әкеп соғады, яғни Q > ε. Біраздан кейін бұл тұрақсыздық жағдай бұзылып тұнба пайда болады. Тәжірибелік байқаудан пайда болған тұнба бөлшектерінің мөлшері реагенттің әр үлесін құйғандағы салыстырмалы аса қанығу мәніне кері пропорционалды. Егер тұнба аз ерісе (ε мәні аз) және концентрлі ерітінділерден (Q үлкен) түсірілсе, онда  үлкен мән. Бұл ерітіндіде көп мөлшерде алғашқы кристалдардың түсуіне, соған сәйкес ұсақ бөлшекті аморфты тұнба түзілуіне себеп болады. Егер
үлкен мән. Бұл ерітіндіде көп мөлшерде алғашқы кристалдардың түсуіне, соған сәйкес ұсақ бөлшекті аморфты тұнба түзілуіне себеп болады. Егер 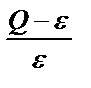 аз болса (Q мөлшері аз, ε үлкен), онда кристалдану орталығы аз пайда болады да, пайда болған орталықтардың әрмен қарай өсу процесі басым болады, сондықтан ірі кристалды тұнба алынады.
аз болса (Q мөлшері аз, ε үлкен), онда кристалдану орталығы аз пайда болады да, пайда болған орталықтардың әрмен қарай өсу процесі басым болады, сондықтан ірі кристалды тұнба алынады.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1666; Нарушение авторских прав?; Мы поможем в написании вашей работы!