
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения атомно-молекулярной теории
|
|
|
|
Основы атомно-молекулярной теории создали русский ученый М.В.Ломоносов (1741 г.) и английский ученый Дж. Дальтон (1808 г.).
Атомно-молекулярная теория – это учение о строении вещества, основными положениями которого являются:
1. Все вещества состоят из молекул и атомов. Молекула – это наименьшая частица вещества, которая способна существовать самостоятельно и не может дробится дальше без потери основных химических свойств данного вещества. Химические свойства молекулы определяются её составом и химическим строением.
2. Молекулы находятся в непрерывном движении. Молекулы двигаются беспорядочно и непрерывно. Скорость движения молекул зависит от агрегатного состояния веществ. С повышением температуры скорость движения молекул увеличивается.
3. Молекулы одного и того же вещества одинаковы, а молекулы различных веществ отличаются массой, размерами, строением и химическими свойствами. Каждое вещество существует до тех пор, пока сохраняются его молекулы. Как только молекулы разрушаются, перестает существовать и данное вещество: возникают новые молекулы, новые вещества. При химических реакциях молекулы одних веществ разрушаются, образуются молекулы других веществ.
4. Молекулы состоят из более мелких частиц – атомов. Атом – это наименьшая частица химического элемента, которую нельзя разложить химическим путем.
Следовательно, атом обуславливает свойства элемента.
Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Химическим элементом называется вид атомов, характеризующихся определенной совокупностью свойств.
В настоящее время элемент определяется как вид атомов, обладающих одинаковым зарядом ядра.
|
|
|
Вещества, молекулы которых состоят из атомов одного элемента, называются простыми веществами (С, Н2, N2, О3, S8 и т.д.).
Вещества, молекулы которых состоят из атомов двух или более элементов, называются сложными веществами ( H2O, H2SO4, KHCO3 и т.д.). Существенное значение имеет число и взаимное расположение атомов в молекуле.
Способность атомов одного и того же элемента к образованию нескольких простых веществ, различных по строению и свойствам называется аллотропией, а образовавшиеся вещества – аллотропными видоизменениями или модификациями, так например, элемент кислород образует две аллотропные модификации: О2 – кислород и О3 – озон; элемент углерод – три: алмаз, графит и карбин и т.д.
Явление аллотропии вызывается двумя причинами: различным числом атомов в молекуле (кислород О2 и озон О3), или образованием различных кристаллических форм (алмаз, графит и карбин).
Элементы принято обозначать химическими знаками. Следует всегда помнить, что каждый знак химического элемента обозначает:
1. название элемента;
2. один атом его;
3. один моль его атомов;
4. относительную атомную массу элемента;
5. его положение в периодической системе химических элементов
Д.И. Менделеева.
Так, например, знак S показывает, что перед нами:
1. химический элемент сера;
2. один атом его;
3. один моль атомов серы;
4. атомная масса серы равна 32 а. е. м. (атомная единица массы);
5. порядковый номер в периодической системе химических элементов Д.И. Менделеева 16.
Абсолютные массы атомов и молекул ничтожно малы, поэтому для удобства массу атомов и молекул выражают в относительных единицах. В настоящее время за единицу атомных масс принята атомная единица массы (сокращенно а. е. м.), представляющая собой 1/12 часть массы изотопа углерода 12С, 1 а. е. м. составляет 1,66 × 10-27 кг.
Атомной массой элемента называется масса его атома, выраженная в а. е. м.
|
|
|
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы изотопа углерода 12С.
Относительная атомная масса величина безразмерная и обозначается Аr,
например, для водорода 

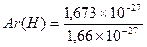

для кислорода  .
.
Молекулярная масса вещества – это масса молекулы, выраженная в а. е. м. Она равна сумме атомных масс элементов, входящих в состав молекулы данного вещества.
Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы изотопа углерода 12С. Она обозначается символом Мr. Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в молекулу с учетом количества атомов. Например, относительная молекулярная масса ортофосфорной кислоты Н3РО4 равна массе атомов всех элементов, входящих в молекулу:
Мr(Н3РО4) = 1,0079 × 3 + 30,974 × 1 + 15,9994 × 4 = 97, 9953 или ≈ 98
Относительная молекулярная масса показывает, во сколько раз масса молекулы данного вещества больше 1 а. е.м.
Наряду с единицами массы, в химии пользуются также единицей количества вещества, называемой молем (сокращенное обозначение «моль»).
Моль вещества – количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится в 12 г (0,012 кг) изотопа углерода 12С.
Зная массу одного атома углерода 12С (1,993 × 10-27 кг), можно вычислить число атомов в 0,012 кг углерода:
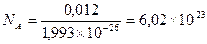
Число частиц в моле любого вещества одно и то же. Оно равно 6,02 × 1023 и называется постоянной Авогадро или числом Авогадро (NА).
Например, в трёх моль атомов углерода будет содержится
3 × 6,02 × 1023 = 18,06 × 1023 атомов
Применяя понятие «моль», необходимо в каждом конкретном случае точно указать, какие именно структурные единицы имеются в виду. Например, следует различать моль атомов водорода Н, моль молекул водорода Н2, моль ионов водорода 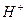 или
или  Один моль частиц имеет определенную массу.
Один моль частиц имеет определенную массу.
Молярная масса – это масса одного моля вещества. Обозначается буквой М.
Молярная масса численно равна относительной молекулярной массе и имеет единицы измерения г/моль или кг/моль.
Масса и количество вещества – понятие разные. Масса выражается в кг (г), а количество вещества – в молях. Между массой вещества (m, г), количеством вещества (n, моль) и молярной массой (М, г/моль) существуют соотношения:
|
|
|
n = 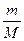 , г/моль; М =
, г/моль; М = 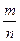 , г/моль; m = n × M, г.
, г/моль; m = n × M, г.
По этим формулам легко вычислить массу определенного количества вещества, молярную массу вещества или количества вещества.
Пример 1. Чему равна масса 2 моль атомов железа?
Решение: Атомная масса железа равна 56 а.е.м. (округленно), следовательно, 1 моль атомов железа весит 56 г, а 2 моль атомов железа имеют массу 56×2 =112 г
Пример 2. Сколько моль гидроксида калия содержится в 560 г КОН?
Решение: Молекулярная масса КОН равна 56 а.е.м. Молярная = 56 г/моль. В 560 г гидроксида калия содержится: 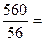 10 моль КОН. Для газообразных веществ существует понятие молярный объём Vm. Согласно закону Авогадро моль любого газа при нормальных условиях (давление 101,325 кПа и температуре 273К) занимает объем 22,4 л. Эта величина называется молярным объемом (его занимают 2 г водорода (Н2), 32 г кислорода (О2) и т.д.
10 моль КОН. Для газообразных веществ существует понятие молярный объём Vm. Согласно закону Авогадро моль любого газа при нормальных условиях (давление 101,325 кПа и температуре 273К) занимает объем 22,4 л. Эта величина называется молярным объемом (его занимают 2 г водорода (Н2), 32 г кислорода (О2) и т.д.
Пример 3. Определить массу 1 л оксида углерода (ΙV) при нормальных условиях (н. у.).
Решение: Молекулярная масса СО2 равна М = 44 а.е.м., следовательно, молярная масса равна 44 г/моль. По закону Авогадро один моль СО2 при н.у. занимает объем 22,4 л. Отсюда масса 1 л СО2 (н. у.) равна 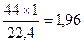 г.
г.
Пример 4. Определить объём, занимаемый 3,4 г сероводорода (Н2S) при нормальных условиях (н.у.).
Решение: Молярная масса сероводорода равна 34 г/моль. Исходя из этого, можно записать: 34 г Н2S при н.у. занимает объем 22,4 л.
3,4 г ________________________ Х л,
отсюда Х = 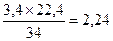 л.
л.
Пример 5. Сколько молекул аммиака содержится:
а) в 1 л б) в 1 г?
Решение: Число Авогадро 6,02 × 1023 указывает на количество молекул в 1 моле (17 г/моль) или в 22,4 л при н.у., следовательно, в 1 л содержится
6,02 × 1023 × 1 = 2,7 × 1022 молекул.
22,4
Число молекул аммиака в 1 г находим из пропорции:
17 г содержат 6,02 × 1023 атомов
 1 г Х,
1 г Х,
отсюда Х = 6,02 × 1023 × 1 = 3,5 × 1022 молекул.
Пример 6. Какова масса 1 моль воды?
Решение: Молекулярная масса воды H2O равна 18 а.е.м. (атомная масса водорода – 1, кислорода – 16, итого 1 + 1 + 16 = 18). Значит, один моль воды равен по массе 18 граммов, и эта масса воды содержит 6,02 × 1023 молекул воды.
|
|
|
Количественно масса 1 моль вещества – масса вещества в граммах, численно равная его атомной или молекулярной массе.
Например, масса 1 моля серной кислоты H2SO4 равна 98 г
(1 +1 + 32 + 16 + 16 + 16 + 16 = 98),
а масса одной молекулы H2SO4 равна 98 г = 16,28 × 10-23 г
6,02 × 1023
Таким образом, любое химическое соединение характеризуется массой одного моля или мольной (молярной) массой М, выражаемой в г/моль (М(H2O) = 18 г/моль, а М(H2SO4) = 98 г/моль).
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 10624; Нарушение авторских прав?; Мы поможем в написании вашей работы!