
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основания
|
|
|
|
Гидроксиды
Гидроксидами называются сложные вещества – продукты взаимодействия оксидов с водой (это условное определение, т.к. большинство основных оксидов с водой не взаимодействует). Гидроксиды подразделяются на основания, кислородные кислоты и амфотерные гидроксиды.
Основаниями называют соединения, в которых положительно заряженный ион металла связан с отрицательно заряженными одним или несколькими гидроксид – ионами и при диссоциации в качестве анионов образуют только гидроксид – ионы 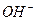 , к ним относятся: KOH, NH4OH, Ca(OH)2, Мg(OH)2 и т.д.
, к ним относятся: KOH, NH4OH, Ca(OH)2, Мg(OH)2 и т.д.
Основания – 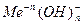 классифицируют по следующим признакам:
классифицируют по следующим признакам:
1) По числу гидроксильных групп  в молекуле основания – различают кислотность оснований и подразделяют их на:
в молекуле основания – различают кислотность оснований и подразделяют их на:
− однокислотные основания: KOH, NаОН, NH4OH и др.;
− двухкислотные основания: Ва(ОН)2, Ca(OH)2, Мg(OH)2 и др.;
− трехкислотные основания: Mn(OH)3, Bi(OH)3, Co(OH)3 и др.
Двух- и трехкислотные основания называются многокислотными основаниями.
2) По степени растворимости в воде:
− растворимые (щелочи);
− труднорастворимые (смотри таблицу растворимости).
Большинство оснований труднорастворимо в воде. Растворимые в воде основания называются щелочами. Растворимые в воде основания образованы щелочными и щелочноземельными металлами. К растворимым основаниям относится гидроксид аммония NH4OH.
Труднорастворимые основания образованы остальными металлами, например: Мg(OH)2, Fe(OH)2 и др.
3) По степени диссоциации (α) различают:
− сильные электролиты α = 1;
− слабые электролиты α < 1.
Нужно помнить: ряды сильных и слабых оснований (таблица 3).
Номенклатура (название) оснований:
Таблица 3 – Формулы и названия оснований
|
|
|
| Сильные основания | Слабые основания | ||
| Формула | Название | Формула | Название |
| LiOH | гидроксид лития | NH4OH | гидроксид аммония |
| NaOH | гидроксид натрия | CuOH | гидроксид меди (I) |
| KOH | гидроксид калия | Fe(OH)2 | гидроксид железа (II) |
| RbOH | гидроксид рубидия | Mg(OH)2 и другие труднорастворимые гидроксиды (смотри таблицу растворимости) | гидроксид магния (II) |
| CsOH | гидроксид цезия | ||
| FrOH | гидроксид франция | ||
| Ca(OH)2 | гидроксид кальция | ||
| Sr(OH)2 | гидроксид стронция | ||
| Ba(OH)2 | гидроксид бария |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 637; Нарушение авторских прав?; Мы поможем в написании вашей работы!