
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 9 страница
|
|
|
|
а) Fe2O3+3CO2=Fe2(CO3)3 а1) FeO+CO2=FeCO3
в) Fe2O3+3H2S=Fe2S3+3H2O в1) FeO+SO2=FeSO3
с) Fe2O3+SO2=Fe2(SO3)3 с1) FeO+H2S=FeS+H2O
д) Fe2O3+3SO3=Fe2(SO4)3 д1) FeO+SO3=FeSO4
е) Fe2O3+N2O3=Fe(NO2)3 е1) FeO+N2O3=Fe(NO2)2

 Fe2O3+nH2O Fe(OH)3 Fe3O4+H2O
Fe2O3+nH2O Fe(OH)3 Fe3O4+H2O
Электрохимиялық коррозия электролитте жүреді. Металдық конструкциялар мен құралдар құймадан жасалған, яғни екі немесе бірнеше металдар бір-бірімен тығыз байланысты болады. Электролит әсерінен бұл металдар (құймалар) көптеген микрогальваникалық жұп түзеді, олар электролитте тотығып және тотықсызданып электроток бөліп шығарады.

Н2О
 ооооо
ооооо


 Си
Си
 е е Fe
е е Fe
Суда барлық уақытта көмір қышқыл газы ериді, сондықтан құйма бетінде электролит бар:
Н2О+СО2=Н2СО3
 Н2СО3 Н++НСО3-.
Н2СО3 Н++НСО3-.
Темір Fe мен мыстың Cu потенциалдары әр түрлі: ЕFeo= -0,44В, ЕCuо=+0,34В. Темір активтілеу металл болғандықтан тотығады, ал электрондар темірден мысқа ағады да су және қышқыл құрамындағы сутек катиондары тотықсызданады.
 Feo-2e=Fe+2 Fe+2+HCO3- =Fe(HCO3)2
Feo-2e=Fe+2 Fe+2+HCO3- =Fe(HCO3)2
2H++2e=H2o
Темір катиондары суда еритін тұз түзеді. Темір біртіндеп осылай тотыға береді де конструкция (құрылыс) бүлінеді.
Жер асты (топырақ) электролитке бай, олар арқылы газдар диффундирланады. Топырақтың элементарлық құрамы (пайыз бойынша %) В.И.Вернадский бойынша:
 O2 Sі Al Fe Ca K Mg H2 Tі, C, Mn, Cl2, S, P
O2 Sі Al Fe Ca K Mg H2 Tі, C, Mn, Cl2, S, P
49.5 25.7 7.5 4.7 3.4 2.4 2.0 1.0 0.1-0.5
Элементтер тұз, оксид түрінде топырақ құрамына кіреді. Тұздар жер асты суымен гидролизге түсіп, ортаның қышқылдық немесе сілтілік реакциясын береді. Сондықтан металл конструкциялары (кабельдер, трубалар) жер астындағы тез коррозияға ұшырайды. Жер астында қала құрылысының немесе электропередачалар линияларының адасып жүрген токтың белгілі кернеуі болады. Сондықтан металл конструкциялары осы ток әсерінен анодтық тотығу арқылы бұзылады.
|
|
|
|
 |
Конструкциядан ток шыққан жерде тотығу жүреді де, металл бұзылады. Көбінесе жер асты коррозиясы осы адасып жүрген ток арқылы болады да, жер асты коммуникациялары тез істен шығады.
Металдар – кристалды заттар, сондықтан бұзылуы да әртүрлі болады. Бетінің біртіндеп тотығуы – бетінің коррозиясы. Кристалдық қабырғаларының жарылуы – кристалл аралық коррозия. Питтинг – коррозия терең металл ішінде болады.
|
 |
|
Коррозиядан қорғау әдістері.
1 Ауаның әсерінен сақтау: май, лак жағу, үлдірлермен қаптау;
2 Металдық қаптау: анодтық және катодтық.
|
|






 а)
а)
 |
 ЕZno= -0.76B
ЕZno= -0.76B
EFeo= -0.44B
Егер екі қабат та ашылып қалса, Fe-де қаптап тұрған Zn анод болады. Zn активтілеу болғандықтан бұзылады, ал темірде электролиттің тотықсыздануы жүреді, негізінен сутегі катиондарының:
 Zn0-2e=Zn+2 Бұл қаптау қауіпсіз, себебі темірді қорғауға
Zn0-2e=Zn+2 Бұл қаптау қауіпсіз, себебі темірді қорғауға
2H++2e=H20 арналған металл бүлінеді.
|
|
 |
 ЕSn0= -0.13B
ЕSn0= -0.13B
EFe0= -0.44B
Қалайының потенциалы темірдің потенциалынан оң таңбаға жақындау болғандықтан ол темірді жақсы қорғайды. Ал егер екі қабат та ашылып қалса (авария нәтижесінде және т.б.), онда активтілеу металл темір бұзылады. Бұл қауіпті катодтық қаптау, себебі негізгі металл бұзылады.
 Fe0-2e=Fe+2 барлық темір бұзылып біткенше Sn0
Fe0-2e=Fe+2 барлық темір бұзылып біткенше Sn0
2H++2e=H20 бүтін күйінде қала береді.
|
|
|
3. Металдарды оксидтендіру.
Кейбір металдар өте жұқа, эластикалық, тесіктері жоқ жақсы адгезиялы лак үлдірі секілді жақсы жабысқыш қабат түзеді. Осы қабат металды бұзылудан сақтайды, себебі ол металдың бетіне оттектің келуін азайтып тоқтатады.
Мұндай металдар коррозияға өте тұрақты:
Zn – ZnO, Cr – Cr2O3, Al – Al2O3, Tі – TіO2 және т.б.
4. Протекторлық қорғау.
Бұл әдіс коррозиядан қорғайтын конструкция электролит ортамен немесе теңіз, жер қыртысы суымен байланысты болғанда қолданылады. Ол үшін протектор ретінде теріс потенциалы жоғарылау, яғни активтілеу металл протектор қолданылады. Ол конструкцияны коррозиядан сақтайды да, өзі бірінші бұзылады. Мысалы, бу қазанының температурасы да, қысымы да жоғары. Қазанның ішіне цинктан жасалған қаңылтыр дәнекерлеп қояды, ол протектор болады. Цинк бұзылып біткен кезде жаңасын дәнекерлейді.
|
 |
|
 Zn0-2e=Zn+2 EZn0= -0.76B
Zn0-2e=Zn+2 EZn0= -0.76B
2H++2e=H20 Eчуг0» -0,40В
Цинк – анод тотығады, шөген қазанның қабырғасында судан сутек тотықсызданады. Электролитке коррозияның жүру жылдамдығын азайтатын ингибиторлар қосып коррозия жүретін ортаны өзгертуге болады. Бұл заттар потенциалды өзгертіп коррозияның жүру жылдамдығын кемітеді.
Мысалы: альдегидтер, нитриттер, белоктар, гетероциклді қосылыстар және т.б. Ингибиторлар коррозияны жүз немесе мың есеге дейін азайтады. Коррозияның кез-келген әдісі - жақсы әдіс, егер ол металды бұзылудан қорғайтын болса. Коррозия өте үлкен стратегиялық, материалдық, экономикалық, финанстық зиян келтіреді. Кейде металдардың ескіруінен ауадағы самолеттер бұзылады да адамдардың өміріне қауіп туғызады. Сондықтан коррозияны зерттеу жұмыстары мен онымен күресу жолдарын іздестіру барлық индустриальді дамыған елдерде жүргізіледі.
Негізгі әдебиет: [1] - 298-310б; [2] – 267-293б; [3] – 260-290б; [4] – 238-256б; [5] – 148-165б; [6] – 276-305б.
Қосымша әдебиет: [8] – 202-215б.
Бақылау сұрақтары:
|
|
|
1. Электродтық потенциал дегеніміз не?
2. Металдардың стандартты электродтық потенциалдары қалай анықталады?
3. Токтың электрохимиялық қатарында металдың күйі нені сипаттайды?
4. Нернст теңдеуін жазыңыз.
5. Гальваникалық элементтің ЭҚК қалай анықталады?
6. Электролиз дегеніміз не? Ол қайда қолданылады?
7. Фарадейдің электролиз заңының теңдеуін жазыңыз.
8. «Электрохимиялық эквивалентң деп нені айтамыз?
9. Ток шығымы қалай анықталды? Ол немен түсіндіріледі?
10. Коррозияның қандай түрлерін білесіз? Коррозиядан қорғаудың қандай әдістерін білесіз?
ІX. Дәріс тақырыбы: Комплекс қосылыстар (1 сағ.).
Дәріс конспектілері:
Комплексті қосылыстар – ерекше байланыс – донорлы-акцепторлы байланыс арқылы түзілген жоғары ретті қосылыстар.
Комплекс қосылыстарды адамдар ерте заманнан практика жүзінде қолданған. Комплекс қосылыстар – асыл тастар, минеральді немесе органикалық бояулар, бұлар – ерте заманда папируста жазу үшін қолданылған және т.б. Бірақ комплекс қосылыстарды зерттеп және оның құрылысын түсіндіретін теорияны тек 1893 жылы Швейцария зимиягі А. Вернер ұсынған.
Донорлы-акцепторлы байланыс донордың дайын валенттік электрон жұбы және акцептордың бос кванттық ұяшығы арқылы түзіледі. Мысалға мына реакцияны алайық:
Cu(OH)2+4 NH4OH =[Cu(NH3)4](OH)2+4H2O
↓ ↓
NH3 H2O
Аммиакта дайын валенттік электрондар жұбы бар: NH3
7N 1S22S2p3
| ↑↓ | ↓ | ↓ | ↓ |
1Н 1S1
| ↑ | ↑ | ↑ |
2S2
Мыс катионының Сu(OH)2 гидроксиді құрамында бос кванттық ұяшықтары бар
атом 29Cu 1S22S2p63S2p64S13d10, яғни
ион Сu+2 …4S0p0d0f0, бос ұяшықтар

 NH3 2+
NH3 2+
 :
:
Сu2++4: NH3= H3N:Cu:NH3
:
NH3
Нейтральді мыс атомының электрондық формуласының аяғы …3d104S14p0, ал Сu2+ ионы - …3d94S04p0, яғни 4-ші сыртқы энергетикалық деңгейі бос.
Мыс катионы өзінің айналасына аммиактың полярлы молекулаларын жинақтайды, ол үшін өзінің бос ұяшықтарына аммиактың дайын валенттік электрондар жұбын тартып алады. Түзілген байланыс донорлы-акцепторлы немесе координативті байланыс деп аталады.
|
|
|
Жоғары ретті комплекс қосылыстардың бірінші ретті қосылыстардан – NaCl, H2O т.б. айырмашылығы бар. Комплекс қосылыстардың ішкі және сыртқы сфералары бар. Ішкі сферасын тік жақшаның [ ] ішіне жазады және оның құрамына:
1) комплекс түзуші металл ионы;
2) лиганда;
3) n – координациялық сан жазылады.
Комплекс түзушілерге «dң және «fң элементтерге жататын ауыр металдар, сирек «рң элементтерінің металдары жатады. Сонымен қатар d-элементтердің нейтральді атомдары Mn, Cr, Fe, Co, Nі жатады.
Лигандаларға қышқыл қалдығы аниондары (ацидо-иондары): І-, Ba-, Cl-, F-, CN-, CNS-, NO2-, S2O32-, OH-…, сонымен қатар полярлы нейтральді молекулалар NH3, H2O, CO, NO… жатады.
Комплекс түзушінің к оординациялық саны оның тотығу дәрежесінен екі есе көп болады, бірақ кейде одан аз болуы мүмкін.
| Комплекс түзушілер | Координациялық саны |
| Ag+, Cu+, Hg2+2, Au+1 | |
| Cu+2,Zn+2, Hg+2, Pt+2, Sn+2,Pb+2, Pd+2, Cd+2 | |
| Cr+3, Fe+2/Fe+3, Nі+2/Nі+3, Co+2/Co+3, Al+3, Au+3, Nb+4, Ta+4, Zr+4, Ge+4, Tі+4 | -6 |
Комплекс қосылыстар негізінен екінші ретті процесс нәтижесінде түзіледі, яғни қиын еритін қосылыстардың еруі немесе гетероқышқылдардың түзілуі кезінде түзіледі. Мысалы:
 1) СuSO4+2NaOH= Cu(OH)2 +Na2SO4
1) СuSO4+2NaOH= Cu(OH)2 +Na2SO4
Cu(OH)2+4 NH4OH =[Cu(NH3)4](OH)2+4H2O
↓ ↓
 NH3 H2O
NH3 H2O
2)  ZnCl2+3/2KOH=2KCl+Zn(OH)2
ZnCl2+3/2KOH=2KCl+Zn(OH)2
Zn(OH)2+2KOH=K2[Zn(OH)4]
3) AuCl3+HCl=H[AuCl]
2KІ+Hg(NO3)2=HgІ2+2KNO3
HgІ2+2KІ=K2[HgІ4]
Осыдан комплекс қосылыстар: гидроксид, тұз, қышқыл қосылыстар болатының көруге болады және комплекс орнын анион немесе катион басатынын көреміз. Мысалы: [Cr(NH3)6]+3, [PtCl6]-2. Комплекс ионның заряды лиганданың табиғатына байланысты. Егер лиганда нейтральды полярлы молекула болса – комплекс катион түзіледі, егер лиганда қышқыл қалдығы болса – комплекс анион түзіледі.
Комплекс ионның, яғни ішкі сфераның заряды ішкі сфераға кіретін барлық иондар зарядтарының алгебралық қосындысы арқылы есептеліп табылады:
[Сr(NH3)6]+3 [HgІ4]-2
↓ ↓ ↓ ↓
+3+0*6=+3 +2-1*4=-2
немесе, егер комплекс қосылыстың толық формуласы берілсе, комплекс ионның заряды сыртқы сфераның кері зарядына тең болады:
[Cr(NH3)6]+3(OH)3-1 K2+[HgJ4]-2
x+(-1*3)=0 +1*2+x=0 x=-2
Комплекс қосылыстардың мынадай түрлері бар:
1) Біртекті немесе лигандалары әр түрлі емес бірдей - [Pt(NH3)6]Cl4;
2) Электролит емес, лигандалары әр түрлі – [Pt(NH3)4Cl2]Cl2;
3) Электролит емес комплекстер - [Pt(NH3)2Cl]0, [Nі(NO)4]0;
4) Қос комплекстер – бикомплекстер, яғни катион да, анион да комплекс ионнан тұрады
[Nі(NH3)6]2[Fe(CN)6]
5) Aвто-комплекстер - K[І*І2], Na[Br -*Br2]
Комплекс қосылыстар ішкі және сыртқы сфераларға диссоциацияланатын күшті электролиттер K4[Fe(CN)6] = 4K++[Fe(CN)6]4-
Ал комплекс ион – аз диссоциацияланатын әлсіз электролит. Комплекс ионның күші сипаттау үшін тепе-теңдік константасы енгізіледі, оны тұрақсыздық константасы деп атайды. Тұрақсыздық константасы неғұрлым аз болса, соғұрлым комплекс ион тұрақты болады.


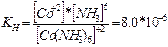 | |||
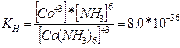 | |||

 [Co(NH3)6]2+ Co2++6NH30 [Co(NH3)6]+3 Co+3+6NH30
[Co(NH3)6]2+ Co2++6NH30 [Co(NH3)6]+3 Co+3+6NH30
Тұрақсыздық константасының зарядының өсуі комплекс ионның тұрақтылығын көрсетеді.
Комплекс қосылыстар әртүрлі химиялық реакцияларға түседі:
1) Алмасу реакциясы
4FeCl3+3K4[Fe(CN)6] = Fe4[Fe(CN)6]3↓ +12KCl
2) Бір заттың ыдырауы нәтижесінде тұнбаға түсі реакциясы
Na3[Ag(S2O3)2]+KІ = K2S2O3+Na2S2O3+AgІ↓
Кн=1,0*10-13 ПР=1,5*10-16
3) Тотығу-тотықсыздану реакциясы
2K3[Fe(CN)6]+2KІ = 2K4[Fe(CN)6]+І2
4) Комплекстердің ыдырау реакциясы
6500
K2[NbCl6] = NbCl4+2KCl және т.б.
Комплекс қосылыстардың аттары ЮПАК бойынша алдымен катион, содан соң анион деп аталады.
Ішкі сфераның аталу реті:
1) Комплекстік сан (2-ди, 4-тетра, 6-гекса);
2) Лиганданың атына + «оң жалғауы жалғанады (хлор-о, циан-о);
3) Орталық атомның латынша аты аталады.
Біртекті емес комплекстерді атау реті мынадай:
1) Комплекстік сан;
2) ацидо-лиганд, нейтральный лиганд;
3) орталық атом.
Мысалы:
а) K3[Fe(CN)6] – калий гексацианоферраты (ІІІ), в) [Co(NH3)4Cl2]SO4 –дихлоротетрааммино кобальт сульфаты (ІІІ).
Құрамы күрделі, яғни құрамында екі катион бір анионмен байланысқан қос тұздар кездеседі. Қос тұздардың комплекс қосылыстардан айырмашылығы – қос тұздар толық диссоциацияланады. Мысалы:
(NH4)2*Fe*(SO4)2*24H2O – Мор тұзы Fe(ІІ) және Fe(ІІІ) кіреді,
NH4*Fe*(SO4)2*24H2O – темір-аммонийлі ашытқылар,
K*Al*(SO4)2*nH2O – алюмокалийлі ашытқылар.
Қос тұздардың комплекс қосылыстардан айырмашылығына әр ионға сапалық реакциялар дәлел бола алады.
NH4*Fe*(SO4)2+4KOH=NH4OH+Fe(OH)3↓+2K2SO4
2NH4*Fe*(SO4)2+6KCNS=(NH4)2+ 2Fe(CNS)3 +3K2SO4
рубинді
NH4*Fe*(SO4)2+2BaCl2=NH4Cl+FeCl3+2BaSO4
K3[Fe(CN)6]+NaCNS= боялмайды.
Анорганикалық химияда комплекс қосылыстар ең кең таралған қосылыстар. Жоғары қышқыл қалдықтары (SO4-2, PO4-3, NO3-, CO3-2, MnO4-, CrO4-2 және т.б.) өте тұрақты комплекске жатады., сондықтан тік жақшасы жазылмайды. Олардың тұрақсыздық константасы өте кішкентай, 10-70 шамасында. Олар оксотұздар деп аталады және тек ТТР нәтижесінде ыдырайды.
Осы айтылған жағдайларға байланысты комплекс қосылыстар адамзат тірлігінің барлық саласында қолданылады.
Негізгі әдебиет: [3] – 71-8 б, [4] – 138-162б; [5] – 224-234б; [6] – 360-364б.
Қосымша әдебиет: [8] – 186-188б.
Бақылау сұрақтары:
1. Қандай қосылыс комплексті деп аталады?
2. Комплекстүзуші дегеніміз не? Мысал келтіріңіз.
3. Лиганда дегеніміз не?
4. Нейтральді комплекстерге, комплексті катиондарға, аниондарға мысал келтіріңіз.
5. Тұрақсыздық константасы дегеніміз не?
6. Лиганда дентатасы дегеніміз не?
7. Валенттік байланыстар әдісі комплекстерде қосылыстарды қалай анықтайды? Донор және акцептор дегеніміз не?
8. Линадалар өрісі теориясы комплекстегі қосылысты қалай түсіндіреді?
9. Комплекс қосылыстар қандай химиялық байланыстарға қосыла алады?
10. Комплекс қосылыстардың қолдану аймағын атаңыз.
2.3. Семинар сабақтарының жоспары.
Тапсырмалар:
1. Химияның негізгі түсініктері мен заңдары. (2 сағ.).
1. Салыстырмалы молекулярлы және молярлық массасын есептеңіз:
а) натрий сульфиді; б) алюминий дигидроксонитраты
2. (қ.ж.) молекула санн, көлемін, массасын есептеңіз:
а) 3 моль азот; б) 0,5моль күкірт (ΙΙ) оксиді.
3. Реакциядағы қышқылдық, негіздің және тұздың эквивалентті молярлық массасын анықтаңыз:
а) 3H2SO4 + Cr(OH)3 = Cr(HSO4)3 +3H2O б) H2SO4 + Cr(OH)3 = CrOHSO4+2H2O
в) 3H2SO4 + 2Cr(OH)3 = Cr(SO4)3 +6H2O
4. Газдың молярлық массасын есептеңіз, егер оның салыстырмалы тығыздығы:
а) сутегі бойынша 22 болса; б) ауа бойынша2,76 болса.
5. Металл массасы және (қ.ж.) ығыстырылған сутегінің көлемі белгілі металдың эквиваленттік массасын анықтаңыз:
а) m=1,4г; V˚H2=0,56л; б) m=0,4г; V˚H2=0,224л.
6. 0,1моль темір (ІV) сульфатындағы темірдің атом санын және массасын анықтаңыз.
7. (қ.ж.) 2моль фторсутегінің көлемін, молекула санын және массасын есептеңіз.
8. 20˚С 0,1кг газ ыдыста 0,02м3 көлемде болады. Оттегінің көлемін анықтаңыз.
9. 25˚С-дегі 30м3 бөлме көлеміндегі толуол буының массасын анықтаңыз. Осы температурадағы толуол буының қысымы 2972Па.
Мысал.
Көміртек атомының массасы 19,93*10-27 кг, ал массаның атомдық бірлігі (м.а.б.) 1,66*10-27кг.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 970; Нарушение авторских прав?; Мы поможем в написании вашей работы!