
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 12 страница
|
|
|
|
д) қиын еритін тұздарды алу
Пробиркаға 1-2 мл қорғасын нитратын немесе ацетатын құйыңыз, содан кейін тұз қышқылын қосыңыз. Түзілген тұнбаның түсін байқаңыз. Тұнбаға калий иодидін қосыңыз. Тұнба түсі қалай өзгереді? Енді аммоний сульфидін қосыңыз. Соңғы тұнбаның түсі қандай? ЕК-ді пайдаланып осы реакциялардың теңдеулерін жазыңыз. Стол полкарында бар тұз ертінділерін пайдаланып төменгі нашар еритін тұздар ертінділерін алыңыз: барий сульфатын, калий карбонатын, барий хроматын, күміс иодидін, цинк фосфатын, калий силикатын.
Жұмысты өндеу.
Лабораториялық дәптерге барлық жасалған реакциялардың теңдеулерін молекулалық және иондық түрінде жазыңыз. Әлсіз электролиттер мен қиын еритін қосылыстардың (еру кестесі) формулаларының қасына Кд және ЕК мәнін жазып қойыңыз.
Бақылау сұрағы:
100 мл-де 8,7 г калий сульфаты болатын ертіндінің молярлық және нормальдық концентрацияларын анықтаңыз.
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс № 6.
Тұздар гидролизі.
6.1 Жұмыстың мақсаты
Тұздардың гидролиздену реакцияларын зерттеу, ортаның рН-ң өзгеруін және гидролиздің температура мен сұйылтуға тәуелді екенін байқау.
6.2 Жұмыстың мазмұны
|
|
|
а) Гидролиз кезінде қышқылдық тұздардың түзілуі.
б) Гидролиз кезінде негіздік тұздардың түзілуі.
в) Бірнеше тұздардың бірге гидролизденуі.
г) Температура мен сұйылтудың гидролизге әсері.
6.3 Теориялық бөлім және жұмыстың барысы
«Гидролиз» деп тұз иондары мен су иондарының арасындағы реакцияны айтады. Реакция нәтижесінде әлсіз электролиттер түзіледі және ертінді ортасының рН-ы өзгереді.
І-жағдай.
Күшті негізден және әлсіз қышқылдан түзілген тұздың гидролизі әлсіз қышқылдың анионы арқылы жүреді:
СО32- + НОН 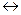 НСО-3 + ОН-
НСО-3 + ОН-
Na2CO3 + HOH 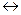 NaHCO3 + NaOH яғни pH > 7.
NaHCO3 + NaOH яғни pH > 7.
ІІ-жағдай.
Әлсіз негізден және күшті қышқылдан түзілген тұздың гидролизі әлсіз негіздің катионы арқылы жүреді:
АІ3+ + НОН 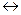 АІОН2+ + Н+
АІОН2+ + Н+
АІСІ3 + НОН 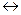 АІОНСІ2 + НСІ яғни pH < 7.
АІОНСІ2 + НСІ яғни pH < 7.
ІІІ-жағдай.
Әлсіз қышқылдан және әлсіз негізден түзілген тұздың гидролизі катион және анион арқылы жүреді.
NН+4 + СН3СОО- + НОН 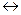 NН4ОН + СН3СООН
NН4ОН + СН3СООН
NН4СН3СОО + НОН 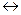 NН4ОН + СН3СООН яғни pH
NН4ОН + СН3СООН яғни pH 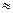 7.
7.
ІV-жағдай.
Әлсіз негізден және әлсіз қышқылдан түзілген тұздың гидролизі бір саты бойынша жүретін қайтымсыз процес, егер реакция нәтижесінде түзілген заттың бірі газ күйінде болса:
АІ2 S + 6HOH 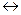 2AІ(OH)3
2AІ(OH)3 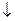 + 3H2S
+ 3H2S  яғни pH
яғни pH 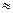 7.
7.
V-жағдай.
Бірнеше тұздардың бірге гидролизі нәтижесінде суда ерімейтін немесе суда кездеспейтін қосылыстар түзіледі.
Аl2(SО4)3 + 3Nа2СО3 + 6HOH = Аl(ОН)3 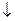 + 3Н2СО3 + + 3Nа2SО4.
+ 3Н2СО3 + + 3Nа2SО4.
2Аl3+ + 3СО32- + 6НОН = 2АІ(ОН)3 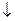 + 3Н2СО3 яғни pH
+ 3Н2СО3 яғни pH 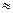 7.
7.
Барлық тәжірибеде жүрген гидролиз реакцияларының молекулалық және иондық теңдеулерін жазыңыз, ортаның рН-н және әлсіз электролиттердің Кд- н көрсетіңіз (кесте).
Қолданылатын реактивтер: Тұздар; калий карбонаты, натрий сульфаты, алюминий хлориді, магний хлориді, аммоний сульфиді, натрий ацетаты, сурьманың қаныққан ертіндісі, дистилленген су, индикаторлар.
|
|
|
1-тәжірибе. Гидролиз нәтижесінде қышқылдық тұздардың түзілуі.
Екі пробиркаға 2-3 мл дистилленген су құйып, 1-2 тамшы фенолфталеин тамызыңыз және 1 микрошпательден төменгі тұздардың кристалдардын салыңыз: 1-ші пробиркаға калий карбонатын, 2-шіге натрий сульфитін. Әлсіз қышқылдардың диссоциациялану константасын пайдаланып гидролиз реакциясының теңдеуінің бірінші сатысын жазыңыз. Қандай тұздың ертіндісінде фенолфталеиннің бояуы ашық болады? Қандай ертіндіде ОН--иондарының концентрациясы жоғарылау болады? Қандай тұздың гидролиздену дәрежесі жоғары болады?
2-тәжірибе. Гидролиз нәтижесінде негізгі тұздардың түзілуі.
Екі пробиркаға 3-4 мл дистилленген су құйып, универсалді индикатор қағазын салыңыз және суда 1-микрошпатель келесі тұздарды ерітіңіз: 1-ші пробиркада - магний хлоридін, 2-ші пробиркада алюминий хлоридін. Қайсысының рН-ы жоғары болады?
3-тәжірибе. Екі тұздың бірге гидролизі.
Бір пробиркаға 6-8 тамшы алюминий хлоридін құйыңыз. Оған сонша тамшы натрий карбонатын құйыңыз. Пробиркада көміртек (ІV) оксидінің бөлінетінін байқаңыз. Осы жағдайда алюминий гидроксидінің тұнбасы түзіледі. Не себептен алюминий карбонаты түзілмейді?
4-тәжірибе. Т емператураның гидролиздену дәрежесіне әсері.
Пробирканың жартысына 1/2 дейін дистилленген су құйыңыз және оған 2-3 микрошпательмен натрий ацетатын салыңыз. Ертіндінің рН мәні нешеге тең? Пробиркаға 1-тамшы фенолфталеин қосыңыз. Пробирканы су моншасына салыңыз, қайнағанға дейін қыздырыңыз. Фенолфталеиннің түсі қалай өзгереді? Гидролиз процесінің тепе-теңдігі қандай бағытта ығысады? Осы құбылыстың себептерін көрсетіңіз.
5-тәжірибе Е ртіндіні сұйылтудың г идролиздену дәрежесіне әсері. Пробиркаға 2-3 тамшы сурьма (ІІІ) хлоридін құйыңыз оған ақ тұнба сурьма хлороксиді - SвОСІ пайда болғанша біртіндеп тамшылатып су құйыңыз. Бұл тұнба гидролиздің екінші сатысында SвОНСl-дан су молекуласы бөлініп шығуы нәтижесінде пайда болады. Түзілген тұнбаны қалай ерітуге болады, яғни гидролиздің иондық тепе-теңдігін сол жаққа қарай қалай ығыстыруға болады?
|
|
|
Жұмысты жазу.
Бақылау сұрағы:
Лабораториялық дәптерге жүрген реакциялардың молекулалық және иондық теңдеулерін, ортаның рН-н көрсетіп жазыңыз.
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс № 7
Тотығу-тотықсыздандыру реакциялары.
7.1 Жұмыстың мақсаты
Тотығу-тотықсыздандыру реакцияларын жүргізу. Элементтердің тотығу дєрежесін анықтау арқылы реакцияны электрондық баланс немесе иондық-электрондық әдістері бойынша теңестіру.
Тотығу-тотықсыздандыру реакциясының жүруі оның өткізу жағдайларға тәуелді екенін зерттеу.
7.2 Жұмыстың мазмұны
а) Натрий сульфитін рН әртүрлі ортада калий перманганатымен тотықтыру.
б) Тотығу дәрежесі әртүрлі күкірттің өзара тотығуы және тотықсыздану процестері.
в) Сутек пероксидінің тотықтырғыштық-тотықсыздандырғыштық қасиеттері.
г) сілтілік ортада йодтың диспропорциялануы
д) аммоний хроматының ішкімолекулалық тотығу-тотықсыздануы
7.3 Жұмыс барысы
Барлық тотығу-тотықсыздану реакциялардың теңдеуін екі жолмен: электрондық баланс және иондық әдіспен көрсетіңіз.
Тотығу-тотықсыздандыру кестесіне қарап, жүйелердің электр қозғаушы күшін (Э.Қ.К.) анықтаңыз.
|
|
|
7.4 Қолданылатын реактивтер мен аспаптар:
1. йодтың кристалдары
2. Тұздардың ертінділері: калий перманганаты, натрий сульфиті, калий дихроматы, натрий сульфиді
3. HCl, H2SO4 ертінділері
4. KOH, NaOH ертінділері
5.бензол, натрий пероксидінің ертіндісі
І-тәжірибе. Натрий сульфидінің калий перманганатымен қышкылдық ортада тотығуы
Пробиркаға 2-3 мл калий перманганатының ертіндісін құйып алып, оған 2-3 мл сұйытылған (2н) күкірт қышқылының ертіндісін қосады, содан кейін ертінді түссізденгенше натрий сульфитін қосады. Қышқылды ортада Mn қандай тотығу дәрежеге дейін тотықсызданады?
2-тәжірибе: Натрий сульфидінің калий перманганатымен нейтралды ортада тотығуы
Пробирқаға 2-3 мл калий перманганатын құйып алып, оған дәл сондай көлемде натрий сульфитін қосады. Ертіндінің түсі қалай өзгереді? Қандай қосылыс тұнбаға түседі? Нейтралды және әлсіз негізді ортада Mn қандай тотығу дєрежеде тұракты болады?
3-ші тәжірибе. Натрий сульфидінің калий перманганатымен сілтілік ортада тотығуы
Пробирқаға 3-4 тамшы концентрленген натрий немесе калий гидроксидін құйып, дәл сондай көлемде натрий сульфитін қосады, содан кейін 2-3 тамшы калий перманганатын құяды. Ертіндінің түсі қалай өзгереді? Қандай ион ертіндіні сондай түске бояйды?
4-ші тәжірибе. Натрий сульфидінің иодпен тотығуы
Иодты судың 2-3 мл (І2)-не 1-2 мл бензол (немесе басқа органиқалық еріткіш) қосады. Пробирканы тығынмен жауып, ертінділерді жақсылап араластырады. Араластырылып болғаннан кейін бензолды қабаттың бояуын байқаңыз (бензол йодты сулы ортадан экстракциялайды). Бірнеше тамшы жаңадан дайындалған натрий сульфидінің ертіндісін немесе бірнеше кристалл түйір натрий сульфитін қосыңыз. Еріткіштің түсі қалай өзгерді? Йод қандай өзгерістерге ұшырады?
5-ші тәжірибе. Күкірттің тотығу дєрежесінің әртүрлі болғандығы өзара тотығуы және тотықсыздануы.
Егер 3-4 мл натрий сульфидінің ертіндісіне 3 мл күкірт қышқылының ертіндісін және 3-4 мл натрий сульфитінің ертіндісін құйып араластырғанда тотығу-тотықсыздану реакциясы жүретінін тексеріңіз.
S2- ¾ S0 ¾ S4+ ¾ S6+
Na2S ® S0 Na2SO3 + H2SO4
6-ші тәжірибе. Сутек пероксидінің тотықтырғыштық-тотықсыздандырғыштық қасиеттері.
Қорғасын сульфидін алу үшін, 2-3 тамшы қорғасын нитратының ертіндісіне 2-3 тамшы сутектік күкірті су қосыңыз. Түскен тұнбаның түсі қандай?
Түскен тұнбаға 3-5 тамшы 3% H2O2 ертіндісін қосыңыз. Тұнбаның түсі қалай өзгерді? KMnO4 + H2SO4 + H2O2 =
7-ші тәжирібе. Сілтілік ортада иодтың диспропорциялануы.
Пробиркаға 1-2 кристалл иод, 3-5 тамшы натрий гидроксидін алып, қыздырыңыз. Ертіндінің түсі қалай өзгереді? Сілтілік ортада йод натрий йодатына дейін (немесе калий йодатына) тотығатынын есепке алып реакцияның теңдеуін жазыңыз. Салқындатқан ертіндіге әлсіз қышқылды ортадаға дейін тамшылап сұйытылған тұз немесе күкірт қышқылын қосыңыз. Қандай өзгерістер байқалады?
8-ші тәжірибе. Аммоний хроматының ішкімолекулалық тотығу-тотықсыздануы.
Құрғақ пробиркаға 2-3 микрошпатель (қалақ) аммоний дихроматын салыңыз және реакция басталғанша қыздырыңыз, содан кейін қыздыруды тоқтатыңыз. Реакцияның жүру ерекшеліктеріне және оның өнімдеріне көңіл аударыңыз: газды – азот және судың буы; қатты – Cr2O3. Реакцияның теңдеуін жазыңыз және тотықтырғыш пен тотықсыздандырғышты көрсетіңіз.
7.5 Жұмысты өңдеу
Бақылау сұрағы:
Лабораториялық дәптерге тәжірибелердің аттарын, реакциялардың теңдеулерін жазыңыз. Реакцияларды электронды және ионды-электронды баланс әдісімен теңестіріңіз, тотығу-тотықсыздандыру реакцияларының э.қ.к. есептеңіз.
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс № 8
Металдардың кернеу қатары және гальваникалық элемент.
1-ші тәжірибе. Металдардың кернеу қатары
Жеті пробиркаға мырыштың, темірдің(ІІ), қалайының, кадмийдің, қорғасынның, мыстың жєне күмістің тұздарының ертінділерін құйыңыз. Мырыш тұзының ертіндісінен басқасына бірдей мырыштың грануларын (түйіршіктерін) салыңыз. Нені байқадыңыз? Орын алатын реакциялардың теңдеулерін жазыңыз.
Мысалы: Zn0 + 2AgNO3 = Zn(NO3)2 + 2Ag0
тотықсыздандырғыш: Zn0 – 2e «Zn2+
тотықтырғыш: 2Ag+ + 2e «2Ag0
Байқаған өзгерістерді кестеге жазыңыз. Металдар бос түрінде өз тұздарынан бөлініп шыққан жағдайда ионның астында плюс қойыңыз, минус, егер метал бос түрінде бөлініп шықпаса.
| Ертіндіге батырылған металл | Стандартты электродты потенциал | Ертіндідегі металдар иондары | ||||||
| Zn2+ | Fe2+ | Co2+ | Sn2+ | Pb2+ | Cu2+ | Ag+ | ||
| Zn0 |
Бөлініп шыққан металдарды тотықсыздандыру қабілеті төмендеген сайын бір қатарға орналастырыңыз және олардың нормалды электродты потенциалдарын көрсетіңіз. Металдардың тәжірибе арқылы алынған қатары олардың металдар кернеу қатарындағы орындарымен сәйкес келе ме?
Кернеу қатары металдардың химиялық активтігін сипаттайды. Бұл қатардан үш маңызды салдарлар шығады:
1. Кернеу қатарында металл неғұрлым солға қарай орналасқан болса, соғұрлым ол химиялық активті болады, тотықсыздандыру қабілеті жоғары, оңай тотығады және өз иондарынан қиын тотықсызданады. Мысалы: натрий металлтүрінде cыртқы бір электронын беріп, жеңіл тотығады Na0-  «Na0, Өйткені натрийдің стандартты потенциалы
«Na0, Өйткені натрийдің стандартты потенциалы  j0 = -2,71 В, ал натрийдің катионы қиын тотықсызданады Na+ +
j0 = -2,71 В, ал натрийдің катионы қиын тотықсызданады Na+ +  = Na0, өйткені оның стандарты потенциалы
= Na0, өйткені оның стандарты потенциалы  j0 = 2,71B тең.
j0 = 2,71B тең.
2 кесте Металдардың кернеу қатары
| Lі+/ Lі0 | Cs+/ Cs0 | K+/ K0 | Ba2+/ Ba0 | Ca2+/ Ca0 | Na+/ Na0 | Mg2+/ Mg0 | Be2+/ Be0 | AІ3+/ AІ0 | Mn2+/ Mn0 | Zn2+/ Zn0 |
| -3,04 | - 3,01 | -2,92 | -2,90 | - 2,87 | - 2,71 | - 2,37 | - 1,85 | -1,66 | -1,19 | -0,76 |
Металл иондарының тотықтыру қасиетінің күшеюі ®
| Cr3+/ Cr0 | Fe2+/ Fe0 | Co2+/ Co0 | Nі2+/ Nі0 | Sn2+/ Sn0 | Pb2+/ Pb0 | H | Cu2+/ Cu0 | Ag+/ Ag0 | Hg2+/ Hg0 | Pt2+/ Pt | Au3+/ Au |
| -0,74 | -0,44 | -0,40 | -0,25 | - 0,14 | - 0,13 | - 0,00 | - 0,34 | 0,80 | 0,86 | 1,20 | -0,76 |
Металдар атомдарының тотықсыздандыру қасиетінің күшюі ®
2. Кернеу қатарындағы әрбір металл өзінен кейін тұратын металдарды олардың тұздарының ертінділерінен ығыстырады.
Мысалы: мыс өзінен кейін тұратын күмісті оның тұзынан ығыстырады
Cu0 + 2 AgNO3 = Cu(NO3)2 + 2Ag0
3. Кернеу қатарындағы сутектен бұрын тұратын металдардың барлығы ертінділерден сутек ионын молекулалық түрінде ығыстырады.
Гальваникалық элемент
Гальваникалық элементте тотығу-тотықсыздандыру реакциясының энергиясы электр энергиясына айналады. Электр қозғаушы күшті тотықтырғыш пен тотықсыздандырғыш потенциалдарының айырымы арқылы табады. Кернеу қатарында металдар неғұрлым бір-бірінен алыс тұрса, соғұрлым э.қ.к. жоғары болады.
2-тәжірибе Даниель-Якобидің гальваникалық элементін құру (мыс-мырыш)
Лаборанттан концентрациялары 1М ZnSО4, CuSO4 және агар-агар толтырылған U – тәрізді көпірше, мысты жєне мырышты электродтарды, көлемі 50 миллилитрлік екі химиялық стакан, штатив, милливольтметр, екі электродты бір-бірімен қосу үшін қажет болатын сым алыңыз (1 сурет).
Екі стаканның біреуіне 20 мл ZnSО4 құйыныз да оған мырыш электродын батырыңыз, ал екіншісіне 20 мл CuSО4 ертіндісін құйыңыз да мыс электродын батырыңыз. Екі стаканды бір-біріне тақау қойып, агар-агар құйылған U-тәрізді қөпіршемен суретте көрсетілгендей екі стаканды қосыңыз. Екі электродты сыммен милливольтметрмен қосыңыз.

1 сурет - Мысты-мырышты гальваникалық элементі
Электр тоғының пайда болғанын милливольтметр стрелкасының қозғалғанынан байқайсыз.
Бақылау сұрағы:
1. Мысты-мырышты гальваникалық элементтің схемасын салыңыз.
2. Мырышты анодта тотығу, мысты катодта тотықсыздандыру жүретін процестердің теңдеулерін жазыңыз. Гальваникалық элементте жүретін тотығу– тотықсыздандыру процесінің жалпы теңдеуін жазыңыз.
3. Гальваникалық элементтің электр қозғаушы күшін есептеңіз.
4. Күмісті AgNO3 ертіндісінен ығыстыру үшін қандай металдарды алуға болады?
5. Қандай металдар және қандай реттілікпен ығысады, егер қорғасынды пластинканы темір (ІІ), магний, мыс (ІІ), сынап(ІІ), және күміс нитраттарының ерітінділеріне батырылған болса? Жүретін реакциялардың теңдеулерін жазыңыз.
Әдебиеттер
1. Практикум по неорганической химии / Под ред.Зломанова В.П.- М.: МГУ, 1994. – 320с.
2. Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. –Алматы: КазНУ, 2002.- 287с.
3. Жалпы химия есептері және жаттығулары / Аханбаев К.А., Алматы, 1986ж. 75б.
Лабораториялық жұмыс № 9
Тұздардың электролизі.
Электролиттің ертіндісі немесе балқымасы арқылы электр тоғы өткенде жүретін тотығу – тотықсыздандыру процесі «электролиз» деп аталады.
Электролиз жүргізетін аспап ішіне екі еритін немесе ерімейтін электродтар батырылған электролиттің ертіндісінен тұрады. Электродтың біреуі сыртқы тоқ көзінің оң полюсына, ал екіншісі теріс полюсына қосылады (1сурет)

1сурет - Электролиз процесі жүретін аспап
Электролиттің табиғатына және электродтың материалына байланысты электролиздің үш түрін ажыратады:
1) индифферентті электродтарда жүретін тұздың сулы ерітіндісінің электролизі;
2) тұздың балқымасының электролизі;
3) еритін электродта жүретін электролиз немесе металдарды тазарту.
1. Графитті электродтарда жүретін натрий хлоридінің сулы ертіндісінің электролизін қарастырайық.
Төменгі схема (сызбанұсқа) бойынша катодта сутек ионы тотықсызданып, сутек молекуласы түзіледі, ал анодта судың молекулалары тотығып, оттек бос түрде бөлініп шығады.
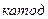
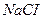








Катодты кеністікте натрий гидроксиді, ал анодты кеңістекте тұз қышқылы түзіледі.
2. Натрий хлоридінің балқымасының электролизі.
Электролиз процесі келесі схема бойынша жүреді:
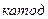
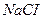



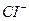
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1096; Нарушение авторских прав?; Мы поможем в написании вашей работы!