
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тапсырма 2 страница
|
|
|
|
18. Құрам тұрақтылық заңы?
19. Зат массасының сақталу заңы?
20. Заттардың эквиваленті дегеніміз не?
21. Авогадро заңының негізгі қағидалары?
22. Эквивалент заңының формуласы?
23. Газ тәрізді зат заңдары?
24. Гей – Люссак заңы?
25. Бойль – Мариотт заңы?
2.2. Есептеу керек: а) газдың келтірілген моль сандарының массасын: б) газдың келтірілген моль сандарындағы молекулалар санын; в) газдың келтірілген моль сандарының көлемін (қ.ж.).
| 1. | Күкіртті сутектің 0,5 молі; | 2. | Аммиактың 2,5 молі; |
| 3. | Азоттың 1,2 молі; | 4. | Көміртек диоксидінің 5,4 молі; |
| 5. | Сутектің 0,8 молі; | 6. | Хлордың 1,5 молі; |
| 7. | Азоттың 3 молі; | 8. | Фтордың 7,5 молі; |
| 9. | Азот оксидінің (ІV) 8,5 молі | 10. | Аммиактың 3 молі; |
| 11. | Фторлы сутектің 1,6 молі; | 12. | Сутектің 12,2 молі; |
| 13. | Оттектің 5,4 молі; | 14. | Күкірт оксидінің (ІV) 3,5 молі |
| 15. | Күкіртті сутектің 2,8 молі; | 16. | Ацетиленнің C2H2 молі; |
| 17. | Метанның CH4 2,6 молі; | 18. | Хлор сутектің 4,4 молі; |
| 19. | Азот оксидінің (ІІ) 5,2 молі; | 20. | Күкірт оксидінің (ІV) 1,2 молі; |
| 21. | Оттектің 0,8 молі; | 22. | Көміртек оксидінің (ІІ) 4 молі; |
| 23. | Аммиактың 0,1 молі; | 24. | Көміртек диоксидінің 3,2молі; |
| 25. | 6,0 моль азота. |
2.3. Салыстырмалы тығыздығы берілген газдың молярлық массасын есептеңіз:
| 1. | 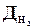 = 14; = 14;
| 2. | 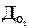 =0,503; =0,503;
| 3. | 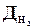 = 19,0; = 19,0;
| 4. | 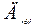 = 1,1; = 1,1;
|
| 5. | 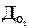 = 1,51; = 1,51;
| 6. | 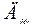 = 2,45; = 2,45;
| 7. | 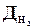 = 38; = 38;
| 8. | 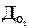 = 2,218; = 2,218;
|
| 9. | 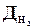 = 23; = 23;
| 10. | 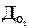 = 2,375; = 2,375;
| 11. | 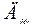 = 1,31; = 1,31;
| 12. | 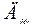 = 2,620; = 2,620;
|
| 13. | 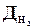 = 8,5. = 8,5.
| 14. | 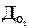 = 3,12; = 3,12;
| 15. | 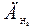 = 31; = 31;
| 16. | 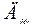 = 2,42; = 2,42;
|
| 17. | 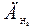 = 7,1; = 7,1;
| 18. | 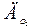 = 1,32; = 1,32;
| 19. | 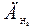 = 28; = 28;
| 20. | 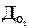 =5,1; =5,1;
|
| 21. | 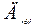 = 1,96; = 1,96;
| 22. | 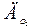 = 1,8; = 1,8;
| 23. | 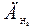 = 19; = 19;
| 24. | 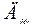 = 3,41; = 3,41;
|
| 25. | 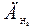 = 21; = 21;
| 26. | 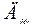 = 5,322; = 5,322;
|
2.4. Реакциялардағы қышқылдардың, негіздердің, тұздардың эквивалентінің молярлы массасын табыңыз:
|
|
|
| 1. | Ba(OH)2+2H2CO3=Ba(HCO3)2+2H2O | 2. | Ba(OH)2+H2CO3=BaCO3+2H2O. |
| 3. | Fe(OH)3+HCl=Fe(OH)2Cl+H2O. | 4. | Fe(OH)3+2HCl=FeOHCl2+2H2O. |
| 5. | Fe(OH)3+3HCl=FeCl3+3H2O. | 6. | H3PO4+KOH=KH2PO4+H2O. |
| 7. | H3PO4+2KOH=K2HPO4+2H2O. | 8. | H3PO4+3KOH=K3HPO4+3H2O. |
| 9. | 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O. | 10. | Al(OH)3+H2SO4=AlOHSO4+2H2O. |
| 11. | 2Al(OH)3+H2SO4=[Al(OH)2]2SO4+2H2O. | 12. | Al(OH)3+3H2SO4=Al(HSO4)3+3H2O. |
| 13. | Ca(OH)2+H3PO4=CaHPO4+2H2O. | 14. | Ca(OH)2+2H3PO4=Ca(H2PO4)2+2H2O. |
| 15. | 3Ca(OH)2+2H3PO4=Ca3(PO4)2+4H2O. | 16. | 3HNO3+Bі(OH)3=Bі(NO3)3+3H2O. |
| 17. | 2HNO3+Bі(OH)3=BіOH(NO3)2+2H2O. | 18. | HNO3+Bі(OH)3=Bі(OH)2NO3+H2O. |
| 19. | Cu(OH)2+HCl=CuOHCl+H2O. | 20. | Cu(OH)2+2HCl=CuCl2+2H2O. |
| 21. | Cr(OH)3+3H2SO4=Cr2(SO4)3+6H2O. | 22. | Cr(OH)3+3H2SO4=Cr(HSO4)3+3H2O. |
| 23. | Cr(OH)3+HF=Cr(OH)2F+H2O. | 24. | Nі(OH)2+2HNO3=Nі(NO3)2+2H2O. |
| 25. | Nі(OH)2+HNO3=NіОHNO3+H2O. |
2.5. Металдың массасы мен ығыстырылған сутектің көлемі бойынша (қ.ж) металл эквиваленттінің молярлық массасын табыңыз:
| Металдың массасы, г | Сутек көлемі, л | |
| 1. | 0,10 | 0,560 |
| 2. | 0,22 | 0,560 |
| 3. | 0,40 | 0,224 |
| 4. | 0,45 | 0,336 |
| 5. | 0,30 | 0,224 |
| 6. | 0,85 | 0,560 |
| 7. | 0,34 | 0,224 |
| 8. | 0,52 | 0,336 |
| 9. | 0,44 | 0,112 |
| 10. | 0,20 | 0,112 |
| 11. | 1,4 | 0,560 |
| 12. | 1,2 | 1,12 |
| 13. | 2,4 | 0,150 |
| 14. | 0,15 | 0,112 |
2.6. Есепті шығарыңыз:
1. Бір газдың құрамында 82,35% азот 17,65% сутек бар. Газдың сутекпен салыстырғандағы тығыздығы 8,5 екенін еске алып, оның молекулалық формуласын анықтаңдар.
2. 0,24 г азоттың сутекпен қосылысын жаққанда қалыпты жағдайда 168 м азот 0,27 г су түзіледі. Бұл заттың ауамен салыстырғандағы тығыздығы 1,1 екенін еске алып, органикалық заттың молекулалық формуласын анықтаңдар.
3. Заттың құрамына калий, хлор, оттек кіреді. Осы заттың 1,02 грамын толық ыдыратқанда 0,62 г калий хлориді түзіледі. Ыдыратуға алынған заттың қарапайым формуласын құрастырыңдар.
4. Заттың құрамына калий, күкірт және оттек кіреді. Осы заттың 0,87 грамындағы күкірт пен оттек барий сульфаты түрінде бөлінген. Түзілген барий сульфатының массасы 1,167 г екенін еске алып, бастапқы алынған заттың қарапайым формуласын анықтаңдар.
|
|
|
5. Натрий нитраты, калий нитраты, кальций нитраты, аммоний нитраты топырақтағы азот мөлшерін көбейту үшін тыңайтқыш ретінде қолданылады. Осы тұздардың қайсысының құрамында азот көп және ол неше процент болады.
6. Құрамында күкірті бар массасы 14,4 г заттан 23,3 г барий сульфаты алынады. Осы зерттеліп отырған заттың құрамындағы күкірттің проценттік мөлшерін анықтаңдар..
7. 200 г кристалдық соданы Na2CO3*10H2O қыздырудың нәтижесінде 63,6 г сусыз тұз натрий карбонаты алынды. Алынған кристалдық содада неше процент бөгде қоспалар болады.
8. 8 моль фосфор оттекке жанғанда неше грамм фосфор /V/ оксиді түзіледі?
9. 6,02.1024Г темір /ІІІ/ гидроксиді ыдырағанда неше моль темір /ІІІ/ оксиді түзіледі?
10. 0,5 моль натрий гироксиді сумен әрекеттескенде қалыпты жағдайда неше литр сутек түзіледі?
11. Темір /Ш/ сульфаты мен калий гидроксидінің әрекеттесуі нәтижесінде 1,07 г темір /ІІІ/ гидроксиді түзіледі. Осы реакцияға неше моль калий гидроксиді қатысты?.
12. Қалыпты жағдайда мыс /ІІ/ оксидін тотықсыздандыруға 22,4 мл сутек жұмсалады. Осы реакцияның нәтижесінде неше молекула су түзіледі?
13. 5,6 г калий гидроксиді бар ыдысқа әрекеттесу үшін 10 г күкірт қышқылы құйылды. Қай қосылыс неше мөлшерде артық алынады?
14. Қалыпты жағдайда 10 г кальций гидроксиді мен әрекеттестіру үшін 2,24 л көміртек /ІV/ оксиді жіберілді. Осы реакцияның нәтижесінде қай зат неше мөлшерде артық қалды және неше кальций карбонаты түзіледі?
15. Қысымы 101,325*103 Па және 170С температурадағы массасы 5 кг ауаның көлемін есепте.
2. Модуль ІІ. Атом құрылысы. Химиялық байланыс.
І Бөлім. Атом құрылысы.
1.1. Теориялық сұрақтар.
1. Резерфордтың атомның планетарлық моделі. Бұл моделдің қандай кемшіліктері бар?
2. Сутек атомының спектрлі сызықша тәріздес болу себебін түсіндіріңіз?
3. Электронның толқындық функциясының физикалық мәнін, бас квант саны,қосымша квант саны, орбиталь дегендерді түсіндіріңіз.
|
|
|
4. Электронның атомдағы энергетикалық күйін қандай квант сандары сипаттайды?
5. Бас квант санының мәні n=4 болатын ІV энергетикалық деңгейдегі деңгейшелердің санын есептеп шығар.
6. Бас квант саны n=4 болса, қосымша және магнит квант сандарының мәндері қандай болады? Магнит квант саны берілген орбиталдың қандай сипаттамаларын көрсетеді?
7. Паули принциптің мәні неде? Атомның деңгейшелеріндегі p7,d12, p4, d3 нейтрондар бола ала ма?
8. Гунд ережесі.
9. Периодтың заңының 1-ші және бүгінгі кездегі анықтамасын беріңіз. Екеуінің қайсысы дұрыстау?
10. Изотоптар дегеніміз не? Әр түрлі элементтердің атомдарының массасы бірдей болуы мүмкін ба? Ондай атомдарды не дейді?
11. Егер атомның а) периодтық системадағы реттік ном3рі; б) периодтың номері; в) орналасқан топтың ном3рі белгілі болса, сол элементтің қандай сипаттамаларын анықтауға болады?
12. Клечковскийдің ережелерін пайдаланып атомдардың обитальдарын толтыру ретін қарастырыңыз.
13. Электронның қосылғыштық энергиясы деген не? Элементтердің периодтық системада реттік номірінің өсуі бойынша периодта және топта бейметалдардың тотықтырғыштық қасиеттері қалай өзгереді?
14. Иондану энергиясы дегеніміз не? Ол қандай бірліктерде өлшенеді? Периодтың системада элементтердің реттік номері өсу бойынша топта S - және P – элементтердің тотықсыздандырғыштық қасиеттері қалай өзгереді?
15. Электротерістік дегеніміз не? Элементтердің периодтық системада реттік номірі өсу ретінде Р – элементтерінің периодта және топта электротерістіктер қалай өзгереді, неге?
16. Әртүрлі элементтер бірдей салмақта бола ала ма?
1.2. Элементтердің атомдарының электрондық және электрондық графикалық формулаларын жазып, олардың қандай электрондық типтерге жататынын анықтаңыз. (S, P, D, f).
|
|
|
| 1. Натрий, селен, калифорний, тантал. | 2. Литий, хлор, осмий, тулий. |
| 3. Кальций, қалайы, вольфрам, эрбий. | 4. Бериллий, аргон, рений, гольмий. |
| 5. Калий, ниобий, сүрме, самарий. | 6. Магний, бром, гафний, америций. |
| 7. Стронций, цинк, йод, гадолиний. | 8. Барий, висмут, кобальт, уран. |
| 9. Цезий, ксенон, марганец, неодим. | 10. Неон, кальций, никель, торий. |
| 11. Рубидий, индий, темір, церий. | 12. Франций, олово, цирконий, лантан. |
| 13. Радий, азот, ванадий, неодим. | 14. Фтор, стронций, ниобий, прометий. |
| 15. Күкірт, барий, рутений, европий. | 16. Оттек, рубидий, палладий, европий |
| 17. Фосфор, цезий, кадмий, диспрозий | 18. Селен, магний, серебро, нептуний |
| 19. Криптон, натрий, хром, гольмий. | 20. Қорғасын, кальций, алтын, плутоний. |
| 21. Йод, литий, тантал, тулий. | 22. Индий, сутек, мыс, иттербий. |
| 23. Гелий, висмут, родий, тербий. | 24. Барий, көміртек, технеций, церий. |
| 25. Ксенон, кальций, кобальт, гадолиний |
1.3. Сыртқы электрондық қабатында электрондардың орналасуы төменде көрсетілгендей болса, ол элемент қай топта және периодта орналасқан (электрондық-графиктік формулаларын жазып, қалыпты және қозған күйлеріндегі валенттілік электрондарын анықта).
| 1. | 2s2p3 | 2. | 3s23p4 | 3. | 3d104s2 |
| 4. | 3d34s2 | 5. | 2p63s1 | 6. | 3p64s1 |
| 7. | 2s22p4 | 8. | 3d104p1 | 9. | 3d74s2 |
| 10. | 3d104s24p3 | 11. | 3d54p1 | 12. | 3d84s2 |
| 13. | 5s25p1 | 14. | 4d15s2 | 15. | 4d95s2 |
| 16. | 2s22p5 | 17. | 4d105s2 | 18. | 3s23p5 |
| 19. | 4d25s2 | 20. | 3d104p2 | 21. | 4p65s2 |
| 22. | 2s22p2 | 23. | 3s23p4 | 24. | 4d105p2 |
| 25. | 4d105p5 |
1.4. Элементтердің берілген тотығу дәрежесіндегі электрондық формуласын жазыңыз:
| 1. | Fe(+3) | 2. | Na(+1) | 3. | Mo(+4) |
| 4. | S(-2) | 5. | Mg(+2) | 6. | Cl(-1) |
| 7. | Ca(+2) | 8. | K(+1) | 9. | O(-2) |
| 10. | Fe(+6) | 11. | S(+6) | 12. | Mo(+6) |
| 13. | Sb(+5) | 14. | Cu(+2) | 15. | Nb(+3) |
| 16. | Nb(+5) | 17. | W(+6) | 18. | Cr(+3) |
| 19. | N(+5) | 20. | V(+5) | 21. | Mn(+7) |
| 22. | Mn(+2) | 23. | As(+5) | 24. | Nі(+2) |
| 25. | N(-3) |
ІІ Бөлім. Химиялық байланыс.
2.1. Теориялық сұрақтар
1.Химиялық байланыстың табиғатын және атомдарын молекула түзілген кезде энергияның бөлінуін түсіндіріңіз.
2.Валенттік байланыс теориясының негізгі қағидалары.
3.«Коваленттік байланыс» деп қандай байланысты атайды?
4.«Полюсті» деп қандай ковалентті байланысты атайды?
5.Қандай коваленттік байланысты «полюссіз» байланыс дейді? Осы байланыстар түзілгендегі қалыптасқан орбитальдің типтерін көрсетіңіз.
6.Атомдық орбитальдардың гибриттелетін маңызды себебі қандай sp, sp2, sp3 гибриттелген орбитальдардың орталық атомға қарағанда кеңістіктегі орналасуы қандай?
7. «Иондық» деп қай химиялық байланысты айтады? Оның түзілу механизмі қандай?
8.CH4(109.50), NH3(107.30), H2O(104.50) молекулалардың кеңістіктегі конфигурациясын (орналасуын) көрсетіңіз, олардың валенттік бұрыштарын салыстырып, өзгертуін түсіндіріңіз.
9.Молекулалардың: BF3 және NH3 қайсысының дипольдық моменті 0-ге тең? Неге?
10. Дипольдің электрлік моменті дегеніміз не? Молекулалардың – HCl, HBr, Hl қайсысының дипольдық моменті ең үлкен?
11. МО-АОСК теориясының негізгі қағидалары.
12. Атомдардың валенттік электрондарының молекуланың энергетикалық диаграммаларының деңгейлерінде орналасу ережелері қандай?.
13. Электрлік дипольдық моменті дегеніміз не?
14. МО әдісі бойынша молекуланың электрондық конфигурациясын жазыңыз?
15. МО әдісі бойынша молекуладағы байланыс тәртібін қалай орналастырады?
16. Парамагнитті молекула дегеніміз не?
17. МО әдісі молекуланың парамагнитті қасиетін қалай түсіндіреді?
2.2 Валенттік байланыс әдісімен көрсетілген молекуланың түзілуін қарастырыңыз. Байланыс типтерін көрсетіңіз.
| 1. | HCl | 2. | H2S | 3. | PCl3 | 4. | NH3 |
| 5. | BeCl2 | 6. | CH4 | 7. | BeF2 | 8. | SіH4 |
| 9. | H2Se | 10. | ZnCl2 | 11. | HF | 12. | PCl5 |
| 13. | BF3 | 14. | H2O | 15. | NF3 | 16. | SF6 |
| 17. | PF5 | 18. | BCl4 | 19. | H2Te | 20. | CCl4 |
| 21. | PCl3 | 22. | Cl2 | 23. | N2 | 24. | BH3 |
| 25. | HgCl2 |
2.3. МО әдісімен молекуланың энергетикалық түзілу диаграммасын көрсетіңіз. Электрондық формуласын жазыңыз. Магниттік қасиетін және байланыс тәртібін анықтаңыз.
| 1. | Lі2 | 2. | O2- | 3. | H2+ | 4. | B2 |
| 5. | He2+ | 6. | H2 | 7. | O2 | 8. | N2 |
| 9. | NO | 10. | NO- | 11. | Cl2 | 12. | C2 |
| 13. | F2 | 14. | He2 | 15. | S2 | 16. | Br2 |
| 17. | P2 | 18. | CO | 19. | F2+ | 20. | O22- |
| 21. | Na2 | 22. | N2+ | 23. | K2 | 24. | O22+ |
| 25. | Ne2+ |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2846; Нарушение авторских прав?; Мы поможем в написании вашей работы!