
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II Общие закономерности химических процессов
|
|
|
|
Химические системы характеризуют такие величины как внутренняя энергия U, энтальпия H, энтропия S и энергия Гиббса G (изобарно-изотермический потенциал). Все они являются функциями состояния, то есть зависят только от состояния системы, но не от способа, которым это состояние достигнуто.
Протекание химической реакции сопровождается изменением внутренней энергии реагирующих систем. Если внутренняя энергия системы уменьшается (∆U<0), то реакция протекает с выделением энергии (экзотермические реакции). Если же внутренняя энергия системы возрастает (∆U>0), то процесс сопровождается поглощением энергии из внешней среды (эндотермические реакции).
Уравнения реакций, в которых количество выделенной или поглощенной теплоты записывается как член уравнения, называются термохимическими уравнениями.
Теплота, выделенная или поглощённая, входящая в уравнение как продукт реакции, называется тепловым эффектом реакции.
Количество теплоты, выделившейся или поглотившейся в результате реакции, зависит только от относительного запаса энергии продуктов и исходных веществ.
Относительный запас энергии, измеренный при постоянном давлении (изобарный процесс, p=const), называется энтальпией H. Изменение энтальпии ∆H равно тепловому эффекту химической реакции, протекающей в изобарно-изотермических условиях (p=const, T=const). В справочниках приводятся стандартные энтальпии образования (∆Ho298), которые относятся к образованию 1 моль соединения из простых веществ в их устойчивых модификациях при t=25oC (298K) и p=101,3кПа.
В основе расчётов тепловых эффектов реакций лежат следующие положения:
Закон Гесса. Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса (это одно из выражений закона сохранения энергии).
|
|
|
Из закона Гесса следует, что термохимические уравнения можно складывать, вычитать и умножать на численные множители.
Пример 7. Определить стандартное изменение энтальпии ∆Ho реакции горения метана
CH4(г) + 2O2(г) ═ CO2(г) + 2H2O(г)
зная, что энтальпии образования CO2(г), H2O(г) и CH4(г) соответственно равны -393,5, -241,8 и -74,9 кДж/моль.
Р е ш е н и е. Запишем термохимические уравнения реакций образования CO2, H2O и CH4 :
C(графит) + O2(г) ═CO2(г); ∆Ho CO2 ═ -393,5 кДж/моль (1)
H2(г) + ½ O2(г) ═ H2O(г); ∆Ho H2O ═-241,8 кДж/моль (2)
C(графит) + 2H2(г) ═ CH4(г); ∆Ho CH4 ═-74,9 кДж/моль (3)
Сложив уравнение (1) с удвоенным уравнением (2) и вычтя из найденной суммы уравнение (3), получим термохимическое уравнение интересующей нас реакции:
CH4(г) + 2O2(г) ═ CO2(г) + 2H2O(г) ;
∆Ho ═ ∆Ho CO2 + 2 ∆Ho H2O - ∆Ho CH4
Используя данные задачи, для искомой величины найдём:
∆Ho ═ -393,5 – 241,8∙2 + 74,9 ═ -802,2 кДж.
Первое следствие из закона Гесса. Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
∆Hoхр═ ∑ νj∆Hoобр.прод.рек. - ∑ νj∆Hoобр.исх.в-в .
При каждом суммировании следует учитывать, в соответствии с уравнением реакции, число молей, участвующих в реакции веществ.
Пример 8. Пользуясь справочными данными, вычислить ∆Ho реакции:
2Mg(к) + CO2(г) ═ 2MgO(к) + C(графит)
Р е ш е н и е. По данным таблицы стандартные энтальпии образования
CO2 и MgO равны соответственно -393,5 и -601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Отсюда для стандартной энтальпии реакции находим:
∆Ho ═ 2∆HoMgO - ∆HoCO2 ═ -601,8∙2 + 393,5 ═ -810,1 кДж
|
|
|
Направление, в котором самопроизвольно протекает химическая реакция, определяется совместным действием двух факторов: 1) тенденцией к переходу системы в состояние с наименьшей внутренней энергией (с наименьшей энтальпией) и 2) тенденцией к достижению наиболее вероятного состояния, перехода из более упорядоченного состояния в менее упорядоченное (с наибольшей энтропией). Энтропия является количественной мерой беспорядка в системе.
Энтропия S является термодинамической функцией состояния системы
S ═ R ln W,
где R-молярная газовая постоянная, 8,31 Дж/(моль∙К), W – термодинамическая вероятность системы.
Термодинамической вероятностью системы называется число микросостояний, с помощью которых осуществляется данное макросостояние.
Единица измерения энтропии - Дж/(моль∙К). Её значение увеличивается с ростом температуры и уменьшается с её понижением. При повышении давления энтропия газа уменьшается, а при понижении – увеличивается. Из изложенного выше ясно, что энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц и особенно частиц в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц) сопровождаются уменьшением энтропии.
Пример 9. Не производя вычислений, определить знак изменения энтропии в следующих реакциях:
NH4NO3(к) ═ N2O(г) + 2H2O(г) (1)
2H2(г) + O2(г) ═ 2H2O(г) (2)
2H2(г) + O2(г) ═ 2H2O(ж) (3)
Р е ш е н и е. В реакции (1) 1моль вещества в кристаллическом состоянии образует 3моля газов, следовательно, ∆S1 >0. В реакциях (2) и (3) уменьшается как общее число молей, так и число молей газообразных веществ, так что ∆S 2 <0 и ∆S3<0. При этом ∆S3 имеет более отрицательное значение, чем ∆S2, так как SH2O(ж) < SH2O(г).
Поскольку энтропия – функция состояния системы, её изменение ∆S в процессе химической реакции можно подсчитать, используя следствие закона Гесса:
∆Sхр ═ ∑ νj∆Soj обр.прод.рек. - ∑ νj∆Soj обр.исх.в-в .
|
|
|
Пример 10. Определите энтропию ∆Sо реакции
H2S(г) + Cl2(г) ═ 2HCl(г) + S(к)
Р е ш е н и е. Поскольку энтропия – функция состояния системы, то её изменение ∆Sох.р. в процессе химической реакции можно подсчитать, пользуясь следствием из закона Гесса:
∆Sох.р. ═ 2SоHCl + SоS(к) – (SоH2S + SоCl2 ).
Подставив соответствующие значения энтропии для каждого из веществ, взятые из таблицы, получаем:
∆Sох.р. ═ 2∙186,7 + 31,88 – 205,6 – 233 ═ - 23,32 Дж/К.
Суммарный эффект влияния энтальпии и энтропии на процессы, протекающие при постоянных температурах и давлении, отражается изменением изобарно-изотермического потенциала G (энергии Гиббса).
∆G ═ ∆H - T∆S.
Стандартную энергию Гиббса реакции рассчитывают по первому следствию из закона Гесса:
∆Goхр ═ ∑ νj∆Goj обр.прод.рек. - ∑ νj∆Goj обр.исх.в-в .
По данному уравнению удобно вычислять стандартную величину изменения энергии Гиббса при 298К,так как значения стандартных энергий образования химических соединений ∆Gо обр приводятся в таблицах термодинамических величин. Стандартные значения энергий Гиббса образования простых веществ в стандартных условиях и наиболее устойчивых модификациях равны нулю.
∆Gо – критерий, определяющий направление самопроизвольного протекания химических процессов. Химическая реакция принципиально возможна, если энергия Гиббса уменьшается, то есть ∆Gо <0.
Пример 11. Какие из перечисленных оксидов (NiO, CuO, CaO, SnO2) могут быть восстановлены до свободного металла при 298К: а) алюминием; б) водородом?
Р е ш е н и е.
3NiO(к) + 2Al(к) ═ Al2O3(к) + 3Ni(к) (1)
NiO(к) + H2(г) ═ Ni(к) + H2O(г) (2)
3CuO(к) + 2Al(к) ═ 3Cu(к) + Al2O3(к) (3)
CuO(к) + H2(г) ═ Cu(к) + H2O(г) (4)
3CaO(к) + 2Al(к) ═ 3Ca(к) + Al2O3(к) (5)
CaO(к) + H2(г) ═ Ca(к) + H2O(г) (6)
3SnO2(к) + 4Al(к) ═ 2Al2O3(к) + 3Sn(к) (7)
SnO2(к) + 2H2(г) ═ Sn(к) + 2H2O(г) (8)
По данным таблицы:
Вещество ∆Gообр, кДж/моль
NiO(к) -211,6
CuO(к) -129,9
CaO(к) -604,2
SnO2(к) -519,3
Al2O3(к) -1582,0
H2O(г) -228,6
Рассчитаем ∆Gо298 для всех указанных реакций:
∆Gо1 ═ -1582 – 3(-211,6) ═ -947,2 кДж
∆Gо2 ═ -228,6 – (-211,6) ═ -17 кДж
∆Gо3 ═ -1582 – 3(-129,9) ═ -1192 кДж
|
|
|
∆Gо4 ═ -228,6 – (-129,9) ═ -98,7 кДж
∆Gо5 ═ -1582 - 3(-604,2) ═ 230,6 кДж
∆Gо6 ═ -228,6 – (-604,2) ═ 376,2 кДж
∆Gо7 ═ 2(-1582) – 3(-519,3) ═ -1606,1 кДж
∆Gо8 ═ 2(-228,6) – (-519,3) ═ -62,1 кДж
О т в е т: при 298К возможны реакции 1, 2, 3, 4, 7. CaO не восстанавливается алюминием и водородом при 298К. SnO2 при этих условиях не может быть восстановлен водородом.
Пример 12. Рассчитать ∆Gо298 реакции
Fe2O3(к) + 3H2(г) ═ 2Fe(к) + 3H2O(г)
и определить, выше какой температуры возможен прямой процесс.
Р е ш е н и е.
По данным таблицы:
Вещество ∆Ho298, ∆Sо298, ∆Gо298,
кДж/моль кДж/моль∙К кДж/моль
Fe2O3(к) -822,2 0,090 -740,3
H2O(г) -241,8 0,190 -228,6
H2(г) 0 0,130 0
Fe(к) 0 0,027 0
∆Gо298 реакции═ 3∙(-228,6) – (-740,3) ═ 54,5 кДж
Таким образом, при Т=298К прямая реакция невозможна. Вероятен обратный процесс – взаимодействие железа с водой (∆Gо298 =-54,5 кДж).
Далее из соотношения ∆G ═ ∆H - T∆S можно рассчитать, при какой температуре установится равновесие (∆G ═ 0, т.е. ∆H = T∆S; Т= ∆H/∆S):
∆Ho298 реакции = (-241,8∙3) – (-822,2) = 96,8 кДж
∆Sо298 реакции = (0,190∙3 + 0,027∙2) - (0,090 + 0,130∙3) = 0,144 кДж/моль∙К
Т=96,8: 0,144 = 672,2 К.
Следовательно, при 672,2 К устанавливается равновесие, а при температуре выше 672,2 К для прямой реакции ∆Gо <0, и процесс возможен.
Возможность (или невозможность) самопроизвольного протекания реакции в зависимости от соотношения ∆H и ∆S приводит к следующим выводам:
1. Если ∆H<0 и ∆S>0, то ∆G<0, т.е. экзотермическая реакция с увеличением энтропии в системе возможна при всех температурах.
2. Если ∆H>0, а ∆S<0, то ∆G>0, т.е. эндотермическая реакция с уменьшением энтропии в системе невозможна ни при каких температурах.
3. Если ∆H<0 и ∆S<0, то знак ∆G экзотермической реакции с уменьшением энтропии зависит от соотношения ∆H и T∆S и возможна при достаточно низких температурах.
4. Если ∆H<0 и ∆S>0, то знак ∆G эндотермической реакции с увеличением энтропии в системе зависит от соотношения величин ∆H и T∆S; и реакция возможна при достаточно высоких температурах.
Скоростью химической реакции называют изменение количества вещества (n) в единицу времени (t) в единице реакционного пространства.
Скорость гомогенной химической реакции – это изменение концентрации одного из веществ в единицу времени. Средняя скорость реакции V ср в интервале времени от t1 до t2 определяется соотношением:

Основные факторы, влияющие на скорость гомогенной химической реакции:
- природа реагирующих веществ;
- концентрация и давление (если в реакции участвуют газы);
- температура;
- катализатор.
Химические реакции по стадийности делятся на элементарные и сложные. Большинство химических реакций являются сложными процессами, протекающими в несколько стадий, т.е. состоящими из нескольких элементарных процессов.
Для элементарных реакций справедлив закон действующих масс: скорость элементарной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов.
Для реакции типа
mA + nB = pC
математическое выражение закона имеет следующий вид:
V = k∙[A]m∙[B]n,
где V – скорость реакции, [A] и [B] – молярные концентрации веществ Аи В, k – константа скорости реакции, m и n – коэффициенты в уравнении реакции. Физический смысл константы скорости заключается в том, что она численно равна скорости химической реакции при концентрациях реагирующих веществ, равных 1моль/л. Константа скорости гомогенной химической реакции зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от концентрации реагирующих веществ.
Скорость химических реакций в гетерогенных системах. Для гетерогенных реакций в уравнение закона действующих масс входят концентрации не всех реагентов, а только газообразных или растворённых. Например, для восстановления оксида железа(II) водородом
FeO + H2 → Fe + H2O
cкорость реакции пропорциональна только концентрации водорода, т.е.
V=k∙[H2].
В гетерогенных системах реакция происходит на поверхности раздела фаз, поэтому, чем больше поверхность соприкосновения, тем больше скорость реакции. Поэтому твёрдые вещества значительно быстрее реагируют в измельчённом состоянии.
Пример 13. Как изменится скорость реакции 2NO(г) + Cl2(г) ↔ 2NOCl(г) ,
если: а) увеличить давление в реакционном сосуде в два раза; б) уменьшить объём сосуда в 4 раза?
Р е ш е н и е.
а) В соответствии с законом действующих масс, скорость данной реакции описывается уравнением: V=k∙[NO]2 ∙[Cl]2. Поскольку увеличение давления приводит к пропорциональному увеличению концентраций газообразных веществ, концентрации реагентов в новых условиях будут равны: [NO]кон=2[NO]нач , [Cl2] кон=2[Cl2]нач . Константа скорости реакции при увеличении давления не изменяется, и скорость реакции в новых условиях будет равна:
Vкон= k∙[NO] 2 кон∙[Cl2]кон = k∙(2[NO])2нач∙(2[Cl2]нач) = 8∙k∙ [NO]2нач∙[Cl2]нач.
Отсюда следует, что
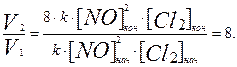
Скорость реакции увеличится в 8 раз.
б) Уменьшение объёма сосуда в 4 раза приводит к соответствующему увеличению концентрации реагентов. Таким образом, [NO]кон=4∙[NO]нач, а [Cl2]кон=4∙[Cl2]нач. Решая задачу по аналогии с предыдущим пунктом, получим 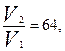 т.е. уменьшение объёма сосуда в 4 раза приведёт к увеличению скорости в 64 раза.
т.е. уменьшение объёма сосуда в 4 раза приведёт к увеличению скорости в 64 раза.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3201; Нарушение авторских прав?; Мы поможем в написании вашей работы!