
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Непредельные ненасыщенные углеводороды ряда ацетилена
|
|
|
|
Основные реакции алкенов
| Название реакции | Примеры |
| 1. Реакции присоединения: гидрирования галогенирования гидрогалогенирования гидратации 2. Полимеризации 3. Реакции окисления: горения действие водного раствора KMnO4 при нагревании действие водного раствора KMnO4 при комнатной температуре (реакция Вагнера) каталитическое окисление (реакция Прилежаева) 4. Реакции дегидрирования 5. Реакции Дильса – Альдера (диеновые синтезы) | СН2=СН2 + Н2 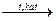 СН3 – СН3
СН3–СН=СН2+Br2 → CH3 – CHBr – CH2Br
СН3–СН=СН2 + HCl → CH3 – CHCl – CH3
СН3–СН=СН2 +H–OH → CH– CHOH – CH3
nСН2=СН2 СН3 – СН3
СН3–СН=СН2+Br2 → CH3 – CHBr – CH2Br
СН3–СН=СН2 + HCl → CH3 – CHCl – CH3
СН3–СН=СН2 +H–OH → CH– CHOH – CH3
nСН2=СН2  [- CH2 – CH2 -]n
nCH2=CH – CH=CH2 [- CH2 – CH2 -]n
nCH2=CH – CH=CH2  [-CH2 –CH=CH – CH2-]n
СН2=СН2 + 3О2 → 2СО2 + 2Н2О
СН2=СН2 +KMnO4→2CO2+4MnO2 + 4KOH
3СН2=СН2 + 2KMnO4 + 4H2O →
3CH2OH – CH2OH + 2MnO2 + 2KOH
[-CH2 –CH=CH – CH2-]n
СН2=СН2 + 3О2 → 2СО2 + 2Н2О
СН2=СН2 +KMnO4→2CO2+4MnO2 + 4KOH
3СН2=СН2 + 2KMnO4 + 4H2O →
3CH2OH – CH2OH + 2MnO2 + 2KOH
  2СН2=СН2 + O2 2СН2=СН2 + O2 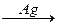 2CH2 - - - CH2
О
оксид этилена
С2Н4 2CH2 - - - CH2
О
оксид этилена
С2Н4 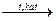 С2Н2 + Н2 С2Н2 + Н2
    СН2 СН2
СН СН2 СН СН2
│ + ║ СН2 СН2
СН СН2 СН СН2
│ + ║  ║ │ ║ │
  СН СН2 СН СН2 СН СН2 СН СН2
 СН2 СН2
СН2 СН2
|
(алкины)
Углеводороды, в молекулах которых атомы углерода связаны друг с другом тройной связью (С≡С), называются ацетиленовыми углеводородами или алкинами. Общая формула ацетиленовых углеводородов с одной тройной связью СnH2n-2. Атомы углерода в ацетиленовых углеводородах находятся в третьем валентном состоянии, которому соответствует sp-гибридизация.
Тройная связь образована одной σ-связью (перекрывание двух гибридизированных sp-атомных орбиталей) и двумя π-связями (перекрывание двух негибридизированных р-орбиталей от каждого соседнего углеродного атома). σ-Связь в тройной связи расположена на одной линии, представляющей собой ось трёх σ-связей. Две π-связи расположены в двух взаимно перпендикулярных плоскостях, которые в сумме создают электронное облако, близкое к «цилиндрическому» («веретенообразному») облаку σ-связи. Это снижает активность π-связей ацетилена, вследствие чего многие реакции присоединения у ацетилена протекают труднее, чем у этилена.
|
|
|
Для ацетилена и его гомологов, у которых сохраняется одна связь С –Н, характерно проявление слабых кислотных свойств. Атомы водорода могут замещаться на атомы металла (серебро, медь, натрий). Причина кислотных свойств Н-атома, связанного с атомом углерода при тройной связи, - повышенная электроотрицательность С-атома в состоянии sp-гибридизации. Такое свойство не существует ни у этиленовых, ни у предельных углеводородов.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!