
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
III. Перекристаллизация
|
|
|
|
Перекристаллизация – важнейший метод очистки твёрдых растворимых веществ от твёрдых растворимых примесей, позволяющий получить очищенное вещество в кристаллическом виде. Он основан на том, что при понижении температуры коэффициенты растворимости большинства твёрдых веществ, уменьшаются, как это видно из таблицы 1.
Таблица 1. Значения коэффициентов растворимости (г/100 г H2O) нитрата натрия и хлорида калия в интервале температур 0 оС – 100 оС.
| t, oC Вещество | |||||||||||
| NaNO3 | 72,7 | 79,9 | 87,6 | 96,1 | 104,9 | 114,1 | 124,7 | 132,2 | 149,4 | 168,6 | 176,3 |
| KCl | 28,0 | 31,2 | 34,2 | 37,2 | 40,1 | 42,9 | 45,8 | 48,6 | 51,3 | 53,8 | 56,3 |
Исходя из величины коэффициента растворимости соли и её массы можно найти объём воды, необходимый для приготовления насыщенного при указанной температуре раствора.
Пример 1. Рассчитайте объём воды, необходимый для приготовления насыщенного при 40 оС раствора нитрата натрия, если масса данной соли равна 6,0 г.
Решение:
1. Из справочной таблицы находим, что коэффициент растворимости NaNO3 при 40 оС равен 104,9 г на 100 г воды.
2. Рассчитаем массу воды, необходимой для приготовления насыщенного при данной температуре раствора, содержащего соль массой 6 г:
Для растворения соли массой 104,9 г необходима вода массой 100 г,
для растворения соли массой 6,0 г необходима вода массой Х г,
откуда находим, что Х = 5,7 г (H2O).
3. Рассчитаем объём этой порции воды:
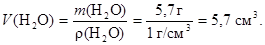
Метод перекристаллизации заключается в следующем. При нагревании до определённой температуры готовится раствор загрязнённого вещества, насыщенный относительно этого вещества, но ненасыщенный относительно примеси (вследствие малого её содержания). При охлаждении такого раствора часть основного вещества из-за уменьшения коэффициента его растворимости выделяется из раствора в осадок в виде кристаллов, а примесь остаётся в растворе.
|
|
|
Перекристаллизация малоэффективна, если примесью является малорастворимое вещество или если примесь изоморфна основному веществу, т. е. образует с ним смешанные кристаллы (одинакового строения и одинаковой формы).
В зависимости от химической природы основного вещества, оно может кристаллизоваться из раствора как в безводном состоянии (K2Cr2O7, NH4Cl и др.), так и в виде кристаллогидратов (CuSO4 ∙ 5H2O, Na2CO3 ∙ 10H2O и др.).
Массу выкристаллизовавшегося вещества можно рассчитать, используя значения коэффициентов его растворимости при указанных температурах.
Пример 2. Рассчитайте массу нитрата натрия, который выкристаллизуется из его насыщенного при 80 оС раствора в результате охлаждения до температуры 20 оС, если для приготовления исходного раствора была использована загрязнённая соль массой 25,5 г. (При проведении расчётов массой примесей пренебречь).
Решение.
1. Из справочной таблицы находим, что коэффициенты растворимости NaNO3 при 80 оС и при 20 оС равны, соответственно, 149,4 г и 87,6 г на 100 г воды.
2. Рассчитаем массу воды, которая содержится в исходном растворе нитрата натрия, насыщенном при 80 оС:
Для растворения соли массой 149,4 г необходима вода массой 100 г,
для растворения соли массой 25,5 г необходима вода массой Х г,
откуда находим, что Х = 17,1 г (H2O).
3. Если при охлаждении насыщенного раствора выделится осадок безводного вещества, то масса воды при этом не изменится и в охлаждённом растворе составит также 17,1 г. Рассчитаем массу соли, которая будет находиться в насыщенном растворе над осадком при температуре 20 оС:
В воде массой 100 г растворяется соль массой 87,6 г,
в воде массой 17,1 г растворяется соль массой Y г,
откуда находим, что Y = 15,0 г (NaNO3).
4. Рассчитаем массу безводной соли, которая выделится из раствора:
|
|
|
m (NaNO3)теор = 25,5 г – 15,0 г = 10,5 г.
Э к с п е р и м е н т а л ь н а я ч а с т ь
Опыт 1.Очистка KCl
Выполнение:
а) Получите у лаборанта навеску загрязнённого KCl массой 10 г.
б) Используя данные таблицы 1, рассчитайте объём воды, необходимый для приготовления насыщенного при 60 оС раствора KCl исходя из полученной навески (массой примеси в ней пренебречь) (См. Пример 1).
в) Отмерьте мерным цилиндром рассчитанный объём воды и перелейте её в стаканчик с навеской.
г) Непрерывно перемешивая смесь, нагрейте её до полного растворения соли, избегая кипения раствора(!).
д) Полученный насыщенный раствор охладите в кристаллизаторе с холодной водой до температуры 10 оС. Во время охлаждения раствора взвесьте пустую фарфоровую чашку:
m 1(чашки) = … г.
е) Соберите прибор для фильтрования при пониженном давлении (рис.6) и отфильтруйте выделившиеся кристаллы KCl.
ж) Аккуратно с помощью шпателя перенесите кристаллы из воронки в чашку.
з) Высушите кристаллы KCl в чашке в сушильном шкафу при температуре 110 оС (7 – 10 минут) и охладите до комнатной температуры.
и) Взвесьте чашку с кристаллами и рассчитайте практическую массу очищенного KCl:
m 2(чашки) = … г; m (KCl) практ = m 2(чашки) – m 1(чашки) = … г.
к) Рассчитайте теоретическую массу m (KCl)теор (см. Пример 2):
m (KCl) теор = … г.
л) Рассчитайте практический выход очищенного KCl (%):
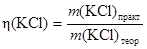 · 100 = … %.
· 100 = … %.
Опыт 2. Сравнительный анализ исходного и очищенного образцов KCl на содержание примеси FeCl3
Для доказательства того, что в результате перекристаллизации содержание примеси FeCl3 в образце KCl резко уменьшается, проведите сравнительный анализ исходного и очищенного образцов хлорида калия. Он заключается в визуальном сравнении интенсивности окраски растворов, возникающей в результате реакции:
FeCl3 + 3KNCS ↔ Fe(NCS)3 + 3KCl.
Образующийся тиоцианат (роданид) железа(III) Fe(NCS)3 придаёт раствору красно-оранжевый цвет, интенсивность которого пропорциональна содержанию FeCl3 в растворе.
Выполнение:
а) В две пробирки внесите по 10 капель воды. В первую из них добавьте образец исходного (загрязнённого) хлорида калия массой ≈ 50 мг (½ шпателя), а во вторую – столько же очищенной вами соли. Содержимое пробирок перемешайте до полного растворения кристаллов.
|
|
|
б) В каждую из пробирок добавьте по 1 капле раствора тиоцианата калия KNCS и перемешайте их содержимое.
Задание:
Сравните интенсивность окраски в пробирках и на основании этого сделайте вывод о сравнительном содержании примеси FeCl3 в исходном и в очищенном образцах.
Когда и что сделать?
Дома перед занятием:
1. Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
2. В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для записи наблюдений, объяснений, расчётов, ответов на вопросы и выводов.
На занятии:
3. Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
4. Уберите своё рабочее место.
Дома после занятия:
5. Выполните необходимые расчёты и запишите их в отчёт.
6. Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
а) В чём заключается сущность метода перекристаллизации?
б) В каких случаях метод перекристаллизации нельзя использовать для очистки веществ? Какие примеси называются изоморфными?
в) Почему при приготовлении насыщенного раствора KCl необходимо избегать кипения жидкости?
г) Почему очищенный вами препарат KCl всё же содержит некоторое количество примеси FeСl3? Как от неё можно избавиться?
============================================================
ЛАБОРАТОРНАЯ РАБОТА № 3
«СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ»
Э к с п е р и м е н т а л ь н а я ч а с т ь
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 4213; Нарушение авторских прав?; Мы поможем в написании вашей работы!